Prantsuse keemiku Henry Louis Le Chatelieri sõnul tasakaalu nihe see on olukord, kus keemiline reaktsioon nihkub (edasi või tagasi) välise häire korral. See keemiku pakutud väide sai nimeks Le Chatelieri põhimõte.
Märge: otsene reaktsioon on see, milles reagendid muundatakse toodeteks, samas kui pöördreaktsioon on see, milles tooted muundatakse reaktantideks.
Reaktsioon on tasakaalus, kui otsese reaktsiooni kiirus on sama kui pöördreaktsioonil, see tähendab reagendid muutuvad toodeteks samas tempos kui tooted reageerijateks.

Tasakaalulise keemilise reaktsiooni üldine esitus
Vastavalt Le Chatelieri põhimõttele, kui jõud toimib tasakaalureaktsioonil, on tasakaalu nihe see toimub selle häire nullimiseks ja reaktsioonis uue tasakaaluolukorra loomiseks.
Häired, mis on võimelised keemilise tasakaalu nihutamine nemad on:
→ kontsentratsiooni muutus
kui kontsentratsioon aine koguses (mol / l või molaar) reaktsioonis osaleja on muutunud (kas vähenenud või suurenenud), tasakaalu nihe, kui see osaleja pole tahkis.
Seega vastavalt Le Chatelieri põhimõttele, kui kontsentratsioon kui osalejat suurendatakse, nihkub tasakaal kasvule vastupidises suunas. Kui aga kontsentratsioon osaleja väheneb, toimub tasakaalu nihkumine languse suunas. Näiteks:

Tasakaalulise keemilise reaktsiooni üldine esitus
A kontsentratsiooni suurendamine = tasakaal nihkub paremale
B kontsentratsiooni vähendamine = tasakaal nihkub vasakule
→ Variatsioon surve
Rõhu kõikumine ainult soodustab tasakaalu nihe millel on gaasilised komponendid, kuna selle suurendamisel suurendavad molekulid üksteisega kokkupõrkeid ja rõhu langetamisel vähendavad üksteisega kokkupõrkeid.
Molekulide kokkupõrked suurenevad kasvades surve, kuna vastavalt vähendatakse helitugevust (tühikut), samal ajal vähendades surve kaasneb suurenev maht.
Märge: Keemilises tasakaalus võetakse rõhu muutmise mõju analüüsimisel arvesse reagentide ja saaduste moolmahtu, mis on seotud reaktsioonikoefitsientidega. Allpool toodud võrrandis on reagendi maht 4 ja saadus 2.
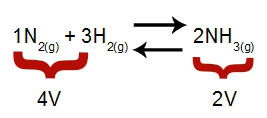
Võrrand, mis näitab ammoniaagi moodustumisel esinevaid mahtusid
Vastavalt Le Chatelieri põhimõttele, kui süsteemi rõhku suurendatakse, siis tasakaal suurema mahu suunas, rõhu langetamisel aga tasakaal.

Ammoniaagi moodustumise tasakaalu esindav võrrand
Suurenev rõhk = tasakaal nihkub paremale (kuna see on vähem helitugevusega pool).
Vähenev rõhk = tasakaal nihkub vasakule (kuna see on suurema helitugevuse pool).
→ Temperatuuri varieerumine
Aasta kasv temperatuur tasakaalureaktsiooni soosib molekule rohkem põrkuma, samas kui temperura vähendab nende ärritust ja sellest tulenevalt ka vapustusi. Kuna temperatuuri tõus soosib alati reaktsiooni endotermiline (selline, mis neelab energiat).
Temperatuuri mõju tasakaalule analüüsimisel võetakse peamiselt arvesse reaktsiooni ΔH. Kui ΔH on positiivne, on edasine reaktsioon endotermiline, vastupidine aga eksotermiline. Kui ΔH on negatiivne, on õige eksotermiline ja pöördvõrdeline endotermiline.
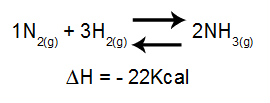
Ammoniaagi moodustumise entalpia variatsiooni sisaldav võrrand
Temperatuuri tõus = tasakaal nihkub vasakule (kuna see on endotermilise reaktsiooni suund, kuna ΔH on negatiivne).
Temperatuuri langus = tasakaal nihkub paremale (kuna see on eksotermilise reaktsiooni suund, kuna ΔH on negatiivne).
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm
