Kuna orgaanilisi ühendeid on tuhandeid, võib isomeeria nähtus olla mitmel kujul. Seetõttu võib isomeeria põhimõtteliselt jagada kahte tüüpi: lame või põhiseaduslik isomeeria ja kosmoseisomeeria või stereoisomeeria. Kõiki mainitud tüüpe saab jagada järgmisele skeemile:
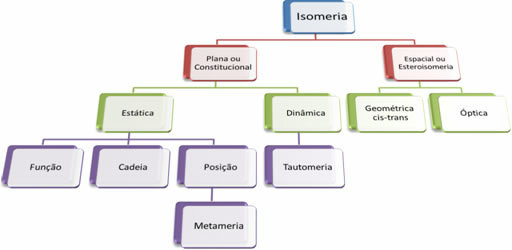
Vaadake kõiki juhtumeid:
1. Kindel või põhiseaduslik isomeeria: Seda tüüpi isomeeridel on sama molekulivalem ja neid eristatakse lamedate struktuurivalemitega. Lennuisomeeriat on viis: funktsioon, ahel, asend, metamerism ja tautomerism.
1.1.Funktsionaalne või funktsionaalne isomeeria: Isomeeride erinevus on funktsionaalses rühmas.
Näide: Molekulivalem C3H6O
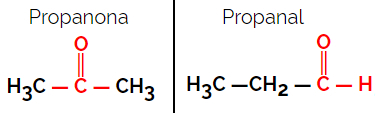
Pange tähele, et propanoon on ketoonrühmast ja propanaal on aldehüüdirühmast.
1.2. Keti või skeleti isomeerid: Isomeeride erinevus seisneb ahela tüübis. Näiteks on üks isomeer avatud ja teine suletud ahelaga või üks on normaalse ja teine hargnenud ahelaga või üks on homogeenne ja teine heterogeenne ahel.
Näide: Molekulivalem C4H10
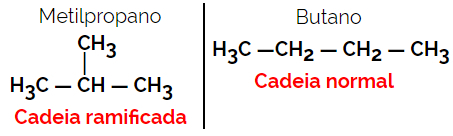
1.3.Asendiline või asendiline isomeeria: Erinevus on küllastumata, funktsionaalse rühma, heteroaatomi või asendaja asendis.
Näide: Molekulivalem C4H6

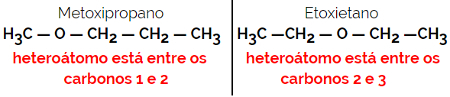
1.4.Hüvitise isomeeria või metameeria: See on positsiooni isomeeria eriliik, kus erinevus seisneb heteroaatomi asendis.
Näide: Molekulivalem C4H10O
1.5.Dünaamiline isomeeria või tautomeeria: See on funktsiooni isomeeria eriliik, kus isomeerid eksisteerivad lahuses dünaamilises tasakaalus. Kaks peamist tautomeeria tüüpi on ketooni ja enooli (ketoenooli tasakaal) ning aldehüüdi ja enooli (aldoenooli tasakaal) vahel.
Näide: Molekulivalem C3H6O
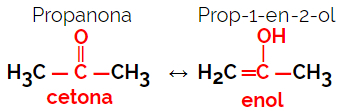
2. Kosmose isomeeria või steroisomeeria: Sellisel juhul saab isomeeride erinevust visualiseerida ainult nende aatomite orientatsiooni kaudu ruumis. Stereoisomeeriaid on kahte tüüpi: geomeetriline isomeeria ja optiline isomerism.
2.1.Geomeetrilised või cis-trans-isomeerid: Erinevus seisneb selles, et isomeer nimetatakse nimega cis sellel on samad süsiniku ligandid kaksiksidemes või tsüklilistes ühendites tasapinna samal küljel. Isomeeriligandid tõlk on vastaskülgedel.
Näide: Molekulivalem C2H2Cl2

Neid ühendeid nimetatakse stereoisomeerid.
2.2.Optiline isomeer: Tekib siis, kui isomeerid suudavad polariseeritud valgusvihku kõrvale juhtida. Kui see painutab polariseeritud valgusvihku vasakule, on see levorotoarne isomeer, kuid paremale paindudes nimetatakse seda paremakäeliseks isomeeriks.
Näide:
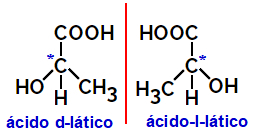
Asümmeetrilisi molekule, nagu eespool näidatud, mis on üksteise peegelpildid ja mis ei ole üksteise peal, nimetatakse nn. enantiomeerid.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

