Aastal liitumisreaktsioonidaastal alkeenid(süsivesinikud, millel on kahe süsinikuaatomi vahel kaksikside), kahe süsiniku vaheline pi-side on katki ja iga süsinik kinnitub uue aatomi külge. Vaata:
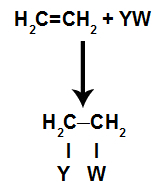
Liitmisreaktsiooni üldine skemaatiline mudel
Liitmisreaktsiooni põhimõtted
a) pi-lingi purunemine
Pi-side on kergesti katki, sest see on nõrgem side kui sigmaside. Kuid selle juhtumiseks on vajalik, et alkeen oleks allutatud tingimustele, mis põhjustavad selle häire. Pärast kahe süsiniku vahelise pi-sideme purunemist ilmub igal kaasatud süsinikul alati sidumiskoht (uute aatomite jaoks).
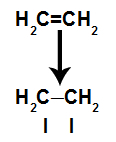
Skemaatiliselt kujutatud pi-lingi purunemist
b) Pi-sideme purunemise tingimused
Pi-sideme purunemist soodustavad tegurid on:
Katalüsaatorite kasutamine;
Küte;
Happe olemasolu reaktsioonikeskkonnas.
c) liitumisreaktsiooni toimumine
Pärast pi-sideme purunemist tekkinud seondumiskohad on alati hõivatud alkeeniga samas mahutis oleva reagendi aatomitega. Lisamisreaktsioon on nimetatud alkeeniga segatud reagendi tüübi järgi.
Liitumisreaktsioonide tüübid alkeenides
a) Hüdrogeenimine
Alkaan segatakse vesinikgaasiga (H2) anumas, töödeldakse tahke katalüsaatoriga (nikkel, plaatina või pallaadium) ja kuumutatakse (A).
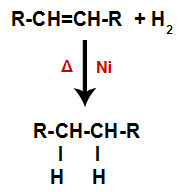
Hüdrogeenimisreaktsiooni üldskeem alkeenides
Katalüsaatori olemasolu ja kuumutamine põhjustavad alkeeni pi-sideme ja H-i vesinike vahelise sigmasideme2 kiiremini katki. Sellega loome alkeenis kaks sidumiskohta ja reaktsioonikeskkonnas kaks vaba vesinikuaatomit.

Aatomi sidumis- ja eralduskohtade loomine
Seega hõivab iga vaba vesinikuaatom vahetult pärast seda ühe alkeenis tekkinud sidumiskoha. Kuna moodustunud aines on ainult süsinikud ja vesinikud ning süsinike vahel on ainult lihtsad sidemed, on see a alkaan.
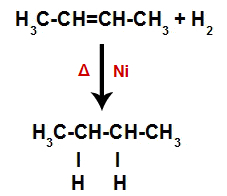
Alkaani moodustumist hüdrogeenimisel esitav võrrand
B) Halogeenimine
Alkaan segatakse lihtsate ainetega (F2, Cl2, br2 Hei2) moodustatud halogeenid (kloor, fluor, jood ja broom) anumas ja allutatakse valguse (λ) ja kuumutamise (Δ) toimele.

Halogeenimisreaktsiooni üldskeem alkeenides
Valguse ja kuumutamise toimel saab alkeeni pi-sideme ja halogeenist moodustunud ainete vahelise sigmasideme kiiremini katki. Sellega on meil alkeenis loodud kaks sidumiskohta ja reaktsioonikeskkonnas kaks vaba halogeeniaatomit.

Aatomi sidumis- ja eralduskohtade loomine
Seega hõivab iga vaba halogeeniaatom vahetult pärast seda ühe alkeenis tekkinud sidumiskoha. Kuna moodustunud ainel on halogeen, mis on seotud süsinikest ja vesinikest koosneva struktuuriga, on see a orgaaniline halogeniid.

Orgaanilise halogeniidi moodustumist halogeenimisel esitav võrrand
c) niisutamine
Alkaan segatakse veega (H2O) anumas ja katalüsaatori (antud juhul väävelhappe) toimel.
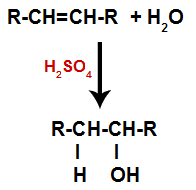
Alkaanide hüdratsioonireaktsiooni üldine skeem
Väävelhappe olemasolu reaktsioonis põhjustab alkeeni pi-sideme ja vesiniku (H) ja hüdroksüül (OH) vahelise sigmasideme kiirema purunemise. Sellega loome alkeenis kaks sidumiskohta ja ühe vaba vesiniku ja ühe hüdroksüülrühma reaktsioonikeskkonnas.
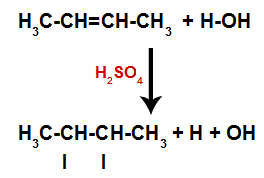
Aatomi sidumis- ja eralduskohtade loomine
Niisiis hõivavad vesinik ja hüdroksüül varsti pärast seda ühte alkeenis moodustunud sidumiskohta. Kuna moodustunud aine on hüdroksüülrühmaga seotud küllastunud süsinikuga (see loob ainult lihtsaid sidemeid), on see alkohol.
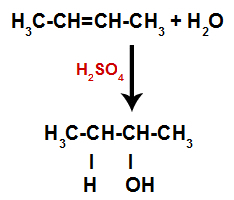
Alkoholi moodustumist hüdratsioonis sisaldav võrrand
d) Lisamine vesinikhalogeniididega
Alkaan segatakse anumas halogeenitud anorgaanilise happega (HF, HI, HCl, HBr).

Happe halogeniidreaktsiooni üldskeem alkeenides
Happe olemasolu reaktsioonis põhjustab alkeeni pi-sideme kiirema purunemise. Happes olev üksikside on katki, kuna need ained ioniseeruvad looduslikult. Seega tekib alkeenis kaks sidumiskohta ja reaktsioonikeskkonnas on vaba vesinik ja halogeen.
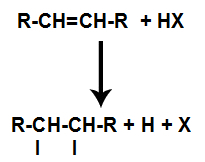
Aatomi sidumis- ja eralduskohtade loomine
Niisiis hõivavad vesinik ja halogeen varsti pärast seda ühe alkeenis tekkinud sidumiskoha. Kuna moodustunud ainel on halogeen, mis on seotud süsinikest ja vesinikest koosneva struktuuriga, on see orgaaniline halogeniid.
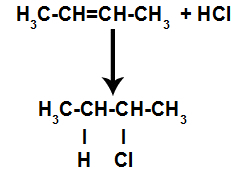
Orgaanilise halogeniidi moodustumist halogeenimisel esitav võrrand
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm
