Igapäevaelus ja laborites on reaktsioone ja transformatsioone, mis on spontaansed, ja teisi, mis pole spontaansed. Näiteks on kogu põlemine spontaanne reaktsioon, sest kui see on alanud, jätkub see seni, kuni kogu kütus on ära kasutatud või kuni kogu hapnik on kadunud.
Teiselt poolt on elektrolüüs mittespontaanne protsess, mille käigus elektrienergia muundatakse keemiliseks energiaks. Näitena võib tuua naatriumkloriidi (NaCl) elektrolüüsi. Kui selle sulasoola kohal juhtida elektrivoolu, toimuvad redoksreaktsioonid ja moodustub metalliline naatrium (Nas)) ja gaasiline kloor (Cl2 g)). Kui lõpetame elektrivoolu juhtimise, ei jätku reaktsioon iseenesest, mis näitab, et see pole spontaanne.
Reaktsiooni spontaansust saab mõõta Gibbsi-Helmholtzi võrrand, antud allpool:

Mille kohta:
∆G = vaba energia variatsioon;
∆H = entalpia muutus;
T = temperatuur kelvinites (alati positiivne);
∆S = entroopia muutus.
See võrrand on oma nime saanud, kuna selle pakkus välja Ameerika füüsik J. Willard Gibbs (1839-1903) ja saksa füüsik Hermann Helmholtz (1821-1894).
Et paremini mõista, kuidas see võrrand aitab meil määrata reaktsiooni spontaansust, vaatame lühidalt üle kõik sellega seotud mõisted:
- ∆H (entalpia variatsioon): Entalpia (H) on aine energiasisaldus. Siiani pole selle kindlaksmääramise viisi teada. Praktikas on saavutatud protsessi entalpia variatsiooni (∆H) mõõtmine kalorimeetrite abil. See variatsioon on summa energia, mis selle käigus vabanes või neeldus.
- ∆S (entroopia variatsioon):Entroopia (S) on termodünaamiline suurus, mis mõõdab süsteemi häirete määra.
Näiteks jää sulamisel liiguvad molekulid tahkest olekust vedelasse olekusse, kus toimub suurem desorganisatsioon. See tähendab, et selles protsessis entroopia kasvas (∆S> 0).
Ammoniaagi (NH3) Reageerib 1 mol gaasilist lämmastikku 3 mol gaasilise vesinikuga (st 4 mol reaktiivides olevate molekulidega), andes tulemuseks 2 mol ammoniaaki:
N2 g) +3 H2 g) → 2 NH3 g)
Kuna selles protsessis gaasifaasi molekulide arv väheneb, vähenes desorganisatsioon, mis tähendab, et ka entroopia vähenes (∆S <0).
- ∆G (vaba energia): Vaba energia või Gibbsi vaba energia (kuna selle pakkus välja ainult see teadlane 1878. aastal) on töö tegemiseks kasutatava süsteemi kasulik energia.
Süsteemil on globaalne energia, kuid ainult murdosa sellest energiast kasutatakse töö tegemiseks, seda nimetatakse Gibbsi vabaks energiaks, mida sümboliseerib G.
Gibbsi sõnul protsessi peetakse spontaanseks, kui see täidab tööd, st kui G väheneb. Sel juhul on transformatsiooni lõppseisund stabiilsem kui algne, kui ∆G <0.
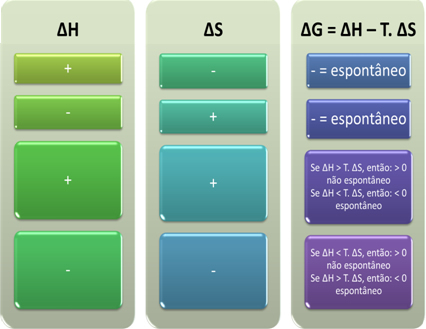
Selle põhjal võime järeldada järgmist:

Samuti näeme, kas protsess on spontaanne, vaadates Gibbsi-Helmholtzi võrrandis ebH ja ∆S algebralist märki:
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
