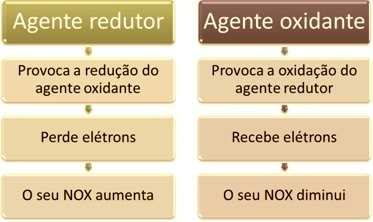
Üks peamisi omadusi, mis eristavad oksüdatsioon-redutseerimisreaktsiooni (või redoks) on oksüdeerija ja redutseerija olemasolu, mida saab defineerida järgmiselt:
Näiteks vaadake allpool toodud keemilist reaktsiooni, kus alumiinium (Al) korrodeerub vesinikkloriidhappe (HCl) vesilahuses. Alumiiniumi aatomid viivad elektronid H katioonidesse+(siin) ja toodavad Al-katiooni3+(siin):
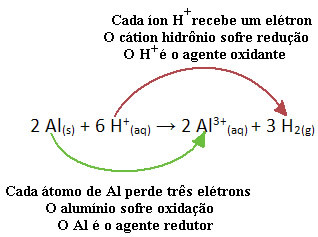
Pange tähele, et kuna Al kandis elektronid üle, tähendab see seda ta põhjustas vähendamise H-katioonidest+(siin); sellepärast teda kutsutakse redutseerija. Juba katioon H+(siin) eemaldas elektronid alumiiniumist, põhjustades oksüdatsiooni sellest metallist; seetõttu tegutseb ta a oksüdeerija.
Igapäevaelus on palju näiteid oksüdeerivate ja redutseerivate ainete toimimisest. Vaadake mõnda neist ja pidage siiski meeles, et kõigil juhtudel toimub redutseerimine samaaegselt oksüdeerumisega; seetõttu on redutseerija olemasolu korral ka oksüdeerija.
- Redutseerijate näited:
- Fotofilmides: fotofilmid sisaldavad valgustundlikke hõbedasooli. Valguse esinemiskohtades väheneb Ag-ioonide hulk +, mille tulemuseks on negatiivides täheldatav kontrast.

- C-vitamiin: C-vitamiin (L-askorbiinhape) on tugev lahus vesilahuses. Sellel on erakordne oksüdeerumisvõimalus ja seetõttu kasutatakse seda laialdaselt, eriti toidus kui antioksüdant, see tähendab, et see lisatakse teistele toitudele ja kaitseb neid võimaliku oksüdeerumise eest ohverdamine. Näitena võib tuua puuviljad nagu õunad ja pirnid, mis õhu hapnikuga kokkupuutel tumenevad, kuna need oksüdeeruvad. Kuid kui lisate puuviljadele väikese koguse apelsini- või sidrunimahla (mis sisaldab C-vitamiini) tükeldatult takistab see selle reaktsiooni tekkimist, sest C-vitamiin toimib redutseerijana ja oksüdeerub enne vilja.

- Gaasiline vesinik: vesinikgaas (H2) kasutatakse rakettide tõukejõus ja seda peetakse üheks olulisemaks energia alternatiiviks, kuna selle põlemisel eraldub suur hulk energiat ja pole ühtegi saasteainet. Selles reaktsioonis toimib vesinik redutseerijana, oksüdeerub hapnikuga.
- Oksüdeerivate ainete näited:
- Äädika tootmisel: kui vein puutub kokku õhu käes, muutub see äädikaks, mille põhikomponendiks on äädikhape. Seda seetõttu, et veinis sisalduv etüülalkohol või etanool oksüdeerub kokkupuutel atmosfääri hapnikuga, mille tulemuseks on äädikhape. Seega on hapnik oksüdeeriv aine. Isegi mõiste „oksüdeerumine” päritolu on seotud reaktsiooniga hapnikuga.

- Roostes: nagu eelmises näites öeldud, toimib hapnik alkoholi oksüdeeriva ainena; ja teeb seda ka kokkupuutel erinevate metallidega, näiteks rauaga, põhjustades roostetamise protsessi. Lisaks õhus olevale hapnikule on antud juhul muud oksüdeerivad ained vesi või happeline lahus.
- Valgendites: pleegitite pleegitusefekt tuleneb kahe järgmise redutseerija olemasolust: o hüpokloritioonioon (tavaliselt naatriumisoola - NaOCl kujul), näiteks pleegitusaines; ja vesinikperoksiid (H2O2), mida turustatakse vesinikperoksiidina. Nendel kahel ühendil on väga tugev kalduvus oksüdeeruda ja põhjustada teiste keemiliste liikide redutseerumist. Seetõttu vastutavad nad ainete oksüdeerimise eest, mis annavad toodetele tumedat värvi. Näiteks tselluloosis lagundatakse ligniin, mis muutub kergemaks ja vormitavamaks. Plekieemalduse ja kanga pleegitamise korral põhjustavad need oksüdeerivad ained orgaaniliste molekulide, näiteks rasvade ja värvainete, oksüdeerumist.

- Alkomeetrites: lihtne ühekordselt kasutatav alkomeeter koosneb läbipaistvast katseklaasist, mis sisaldab väävelhappega niisutatud kaaliumi ja ränidioksiidi dikromaatsoola vesilahust; segatud oranži värviga. See sool, puutudes kokku purjus juhi hingeõhus sisalduva alkoholiauruga, reageerib, muutes värvi roheliseks. See tähendab, et on põhjustatud etanooli (alkoholi) oksüdeerumine etanaaliks.

Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm
