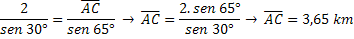Võimsus, mida ühendused peavad elektrilaengute saamiseks tõmbama, on määratletud kui polaarsus, mis omandab erineva iseloomu sõltuvalt ühendusest, kus see olemas on.
Orgaanilisi ühendeid hõlmavad kõige sagedamini sidemed süsinikuaatomite vahel või süsiniku- ja vesinikuaatomite vahel: C ─ C ja C ─ H (süsivesinikud). Klassifitseerime seda tüüpi sidemeid kovalentseteks, need esinevad kõigis orgaaniliste ühendite sidemetes, mis moodustuvad ainult süsiniku ja vesiniku mõjul.
Kui orgaanilise ühendi molekulis on peale süsiniku ja vesiniku veel mõni keemiline element, on selle molekulidel teatud polaarsus. Nimetame seda elementi heteroaatomiks ja see võib olla muu hulgas lämmastik (N), hapnik (O).
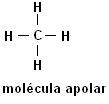
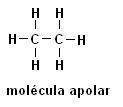
Metaan (CH4) Etaan (C2H6)
Pange tähele, et mõlemas struktuuris ei esine heteroaatomeid, sellisel juhul klassifitseeritakse molekulid mittepolaarseteks.


Hapniku kui heteroaatomi olemasolu muudab molekulid polaarseks. Esimene molekul on ühend Etanool (CH3CH2oh), annab hüdroksüül-OH olemasolu sellele ühendile polaarse iseloomu, isegi kui see sisaldab oma struktuuris mittepolaarset osa.
Autor Líria Alves
Lõpetanud keemia
Brasiilia koolimeeskond
Näe rohkem! lame isomeer
Orgaaniline keemia - Keemia - Brasiilia kool
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm