osmoskoopia on kollektiivne omand (teised on tonoskoopia, ebullioskoopia ja krüoskoopia), mis uurib osmoos kahe erineva kontsentratsiooniga lahuse vahel, millest üks on kontsentreeritum kui teine.
Märkus: kollektiivsed omadused ilmnevad siis, kui lahustile lisatakse mittelenduv lahustunud aine.
Nagu näiteks osmoskoopia osmoosi uurimiseks on see hädavajalik teada Mis on see nähtus. Selleks kasutame allpool toodud lahendusi, mis on eraldatud poolläbilaskva membraaniga:
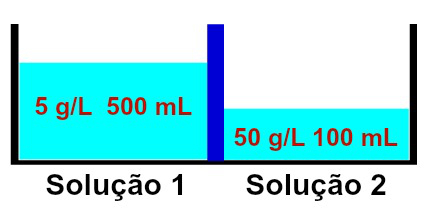
Erineva kontsentratsiooniga lahuste kujutamine
Täheldatakse, et lahus 1 sisaldab kontsentratsiooni 5 g / l ja mahtu 500 ml, samal ajal kui lahus 1 lahuse 2 kontsentratsioon on 50 g / l ja maht 100 ml, eraldatuna membraaniga poolläbilaskev. Lahus 2 on kontsentreeritum kui lahus 1 ja seetõttu peab nende vahel tekkima osmoos.
Osmoos peab tingimata toimuma lahusest 1 lahuseni 2, kuna lahus 1 on vähem kontsentreeritud. Selle esinemise ajal läbib osa lahustist poolläbilaskva membraani, muutes lahuse mahuks 2 suureneb ja lahuse 1 maht väheneb, kuni mõlema lahuse kontsentratsioon hakkab olema sama, see tähendab isotoonia.

Lahuste 1 ja 2 kõrguse muutmine osmoosi esinemise tõttu
Märkus: isotoonilised keskkonnad on need, mille kontsentratsioon on võrdne.
Vastavalt osmoskoopia, toimub osmoos, kuna lahusti maksimaalne aururõhk vähem kontsentreeritud lahuses on suurem kui lahuse kontsentreeritumas lahuses. Kui tahame osmoosi teket ära hoida, avaldage survet kõige kontsentreeritumale lahusele:
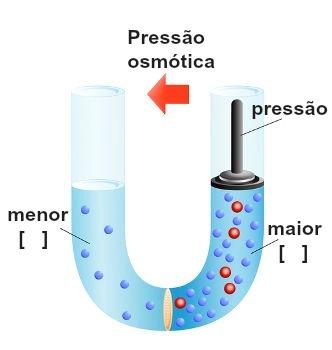
Surve täitmise kujutamine kõige kontsentreeritumal lahusel
Seda rõhku, mis avaldub kõige kontsentreeritumale lahusele, et blokeerida või isegi pöördosmoos, nimetatakse osmootne rõhk ja seda tähistab sümbol π. See peaks olema otseselt proportsionaalne lahuse kontsentratsiooniga.
Osmootse rõhu võimalikud tõlgendused
Vastavalt komisjoni järeldustele osmoskoopia, on igal lahusel osmootne rõhk, kuna see on seotud kontsentratsiooniga, mis on iseloomulik igas lahuses.
Ühe meediumi või ühe lahenduse võrdlemisel võime kasutada järgmisi mõisteid:
Hüpertooniline: kui ühe keskkonna osmootne rõhk on suurem kui teine;
hüpotooniline: kui ühe keskkonna osmootne rõhk on madalam kui teisel;
Isotooniline: kui kahel söötmel või lahusel on sama osmootne rõhk.
Seega, kui võrrelda kahe lahuse A ja B osmootset rõhku, mida tähistab πTHE ja πB, võime öelda, et:
Kui A ja B osmootne rõhk on võrdsed, on keskmised või lahused isotoonilised:
πTHE = πB
Kui A osmootne rõhk on suurem kui B osmootne rõhk, on keskkond A B suhtes hüpertooniline:
πTHE> πB
Kui B osmootne rõhk on väiksem kui A osmootne rõhk, on keskkond B B suhtes hüpotooniline:
πB< πTHE
Valem osmootse rõhu arvutamiseks
π = M.R.T
Selles valemis:
π = on osmootne rõhk
M = on kontsentratsioon mol / l
R = üldine gaasikonstant (0,082 rõhu jaoks atm; Rõhk (mmHg): 62,3)
T = temperatuur kelvinites
Kuna kontsentratsioonil mol / l on konkreetne valem, nagu allpool näidatud:
M = m1
M1.V
Saame selle asendada osmootse rõhu valemis:
π = m1.R.T
M1.V
Märkus. Kui lahuses sisalduv lahustunud aine on ioonne, peame kasutama Van't Hoffi parandustegur i) osmootse rõhu arvutamisel:
π = M.R.T.i
Osmootse rõhu arvutamise näide
Näide: (UF-PA) Lahus, mis sisaldab 2 mg uut antibiootikumi 10 ml vees temperatuuril 25 ° C, osmootse rõhu on 0,298 mmHg. Niisiis on selle antibiootikumi molekulmass ligikaudu:
a) 3000
b) 5200
c) 7500
d) 12500
e) 15300
Harjutuse käigus saadud andmed olid:
π = 0,298 mmHg
T = 25 OC või 298 K (pärast liitmist 273-ga)
m1 = 2 mg või 0,002 g (pärast jagamist 1000-ga)
V = 10 ml või 0,01 L (pärast jagamist 1000-ga)
R = 62,3 mmHg
Selle harjutuse lahendamiseks rakendage osmootse rõhu arvutamiseks avaldises lihtsalt olemasolevaid andmeid järgmiselt:
π = m1.R.T
M1.V
0,298 = 0,002.62,3.298
M1.0,01
0,298M1.0,01 = 37,1308
0,00298M1 = 37,1308
M1 = 37,1308
0,00298
M1 = 12460 u
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-osmoscopia.htm
