THE Reaktsioonikiiruse seadus seostab keemilise muundumise kiiruse reaktiivide kontsentratsioonidega aine koguses (mol / L), mida saab öelda järgmiselt:

Mõelge näiteks järgmisele üldisele reaktsioonile:
aA + bB → cC + dD
Oletame, et suurendame reaktiivide A ja B kontsentratsiooni, mis saab reaktsiooni kiirusest? Noh, kuna reageerivate osakeste kogus suureneb samas ruumis, toimuvad nende vahel tõhusamad kokkupõrked, mille tulemuseks on reaktsiooni arengu kiiruse suurenemine. Mis tähendab, et see suurendab teie kiirust.
Seetõttu on reaktsioonikiirus otseselt proportsionaalne reagentide kontsentratsiooniga. Kuid see sõltub ka temperatuurist. Seetõttu on meil järgmine matemaatiline võrrand, mis tähistab reaktsioonikiiruse seadust:

Mille kohta:
v = reaktsioonikiirus;
k = konstant, mis sõltub ainult temperatuuri väärtusest;
α ja β = katseliselt määratud eksponendid.
Ainult siis, kui reaktsioon on elementaarne, see tähendab, et see toimub ühes etapis, on eksponendid täpselt võrdsed tasakaalustatud keemilise võrrandi koefitsientidega:
v = k. [THE]The. [B]B. Kuid muudel juhtudel tuleb eksperimentaalselt määrata sobiv tugevus, milleni tuleb suurendada iga reagendi kontsentratsiooni.Reaktsioonide kiiruse seadus käib paljude nimede järgi, siin on mõned: Massitegevuse seadus, kiiruse võrrand, reageerimise kineetiline seadus ja Guldberg-Waage'i seadus.
Mõelge selle seaduse rakendamise näitele:
Mõelge järgmisele põhireaktsioonile:
2 HCl g) → H2 g) + Cl2 g)
a) kirjutage selle reaktsiooni kiiruse võrrand;
b) Katsete abil märgiti allpool toodud tabelis vesinikkloriidgaasi lagunemisreaktsiooni kiirus ja reaktiivi kontsentratsioon konstantsel temperatuuril 25 ° C:
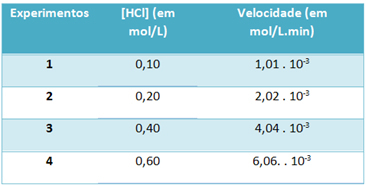
Selle põhjal määrake selle reaktsiooni iseloomulik kiiruskonstant mainitud temperatuuril.
Resolutsioon:
) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
Tähe “b” lahendamiseks võite kasutada mis tahes katse andmeid, et saadud väärtus oleks sama.
Aga mis siis, kui reaktsioon pole elementaarne? Kuidas on võimalik selliseid küsimusi lahendada elementaarsetes reaktsioonides? Kuidas teada saada, lugege mitte-elementaarsete reaktsioonide kiiruse seadust.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm

