THE hassium, sümboliga Hs ja aatomnumber 108, on üks elemente, mida nimetatakse transaktiniidideks. Nagu kõiki selle rühma elemente, ei leidu seda looduses, kuna see on sünteetiline, lisaks on radioaktiivne ja ebastabiilne. Selle süntees kuulub Helmholtzi raskete ioonide uurimise keskuse (GSI) Saksamaa laborite arvele. Saksamaal Darmstadiumis ja selle nimi anti Saksamaa keskosas asuva Hesseni liidumaa auks. vanemad.
Hassium on kõige raskem element, mille omadusi on GSI enda tehtud katsete abil analüüsitud. Tulemused olid olulised H-de positsiooni kinnitamiseks Perioodilisustabel, kuna tajuti selle elemendi sarnasust 8. rühma kergemate elementide osmiumi ja ruteeniumi vahel.
Loe ka:Bohrium — Niels Bohri järgi nimetatud sünteetiline keemiline element
Hassiumi kokkuvõte
See on sünteetiline keemiline element, mis asub perioodilise tabeli 8. rühmas.
Selle sünteesis Saksamaal Darmstadiumis asuv Gesellschaft für Schwerionenforschung (GSI).
See on radioaktiivne element ja ebastabiilne.
Teoreetilised ja eksperimentaalsed andmed kinnitavad, et selle omadused meenutavad oma rühma kõige kergemaid elemente.
Transaktiniidina ei saa seda suures mahus toota, välja arvatud mõne üksiku kiirusega. aatomid.
Ära nüüd lõpeta... Pärast kuulutust on rohkem ;)
Hassiumi omadused
Sümbol: hs
Aatomnumber: 108
Aatommass: 277 c.u.
Elektrooniline konfiguratsioon: [Rn] 7s2 5f14 6d6
Kõige stabiilsem isotoop: 269Hs (14 sekundit poolväärtusaeg)
Keemiline seeria: rühm 8; transaktiniidid; ülirasked elemendid.
Hassiumi omadused
Hassium on a sünteetiline element ja 8. rühma raskeim. Seda peetakse a transaktiniidi, just sellepärast, et see ilmub perioodilises tabelis pärast aktiniidide seeriat. Nagu kõik transaktiniidid, on hassium element radioaktiivne ja ebastabiilne.
See tähendab, et selle isotoobid jõuavad vähe aega pool elu (aeg, mis kulub aatomiliigi massi vähenemiseks poole võrra). Praegu on teada seitse hassiumi isotoopi, mille mass varieerub vahemikus 264 a.m.u kuni 270. a.m.u. Kõigist kõige stabiilsem on isotoop 269Hs, poolväärtusajaga 14 sekundit.
Kuigi lühike poolestusaeg muudab transaktiniidide keemiliste omaduste uurimise keeruliseks, on hassiumil selles osas veidi rohkem vedanud. Juunis 2001 teatati, et temast sai raskeim element, mille omadusi analüüsitakse.
Meeskonnal õnnestus Saksamaal Darmstádio linnas toota umbes kuus Hs aatomit poolestusajaga umbes 10 sekundit. Kuigi see tundub vähe, piisas sellest, et kinnitada, et hassiumoksiid HsO4, on tugevalt sarnane 8. rühma kergemate elementide RuO oksiididega4 ja OsO4, see tähendab ruteenium see on osmium.
Vaata ka: Seaborgium on teine sünteetiline keemiline element, millel on radioaktiivsed omadused ja lühike poolestusaeg
Hassiumi saamine
Transaktiniididele on ühine tootmisraskus. Üldjuhul on vaja nüüdisaegset tehnikat, nt osakeste kiirendid. Nendes põrkuvad ioonilised liigid kõrgete elementidega aatommass üliraskete elementide moodustamiseks (millesse on kaasatud Hs).
Hassiumi puhul hõlmasid uuringud, mis kinnitasid selle positsiooni perioodilise tabeli rühmas 8, selle tootmist magneesium-26 pommitamise teel, mille sihtmärgiks oli kuurium-248.
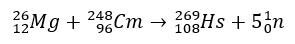
Neid elemente hõlmavad katsed on kallid ja seetõttu on tavaline, et teoreetilisi uuringuid tehakse just keemiliste omaduste arvutamiseks ja ennustamiseks. Lühike poolestusaeg on veel üks komplitseeriv tegur.
Eksperimentaalsed tehnikad eraldamine ja tuvastamine peab olema väga kiire, et saada usaldusväärseid tulemusi. Lõpuks on nende elementide reaktsiooni efektiivsus väga madal, jäädes mõne aatomiühiku vahemikku.
Ettevaatusabinõud Hassiumi kasutamisel
H-d ei toodeta suures mahus ja seetõttu ka sellega manipuleerimine ei sisalda riske. Lisaks saadakse seda kõrgelt kontrollitud keskkonnaga uurimiskeskustes.
hassiumi ajalugu

Transaktiniidid olid teadusliku vaidluse peategelased, kuna Külm sõda, a Ülekannete sõda, nimi, mis on loodud viitega vaidlustele, mis hõlmasid fermiumi (Fm, Z = 100) elementide tootmist ja tunnustamist. Sellel võistlusel osalesid laborid:
Tuumauuringute ühendinstituut Venemaal Dubna linnas;
Lawrence Berkeley riiklik labor Berkeleys, Californias;
Gesellschaft für Schwerionenforschung (GSI, paremini tõlgitud kui Helmholtzi raskete ioonide uurimiskeskus) Saksamaal Darmstadiumis.
Elemendi 108 puhul olid kaasatud GSI ja Dubna rühmad. Kuigi Dubna teadlased (juhatas Juri Oganessian) teatasid esmalt elemendi 108 olemasolust, võtsid Saksa grupi esindajad selle au, kuna GSI esitas veenvamaid tulemusi, kusjuures ühes katses õnnestus tal toota kolm isotoobi 265 aatomit, teises aga ühe isotoobi 264 aatomit.
Need isotoobid valmistati universaalse lineaarse kiirendi (Unilac, parem tõlkes universaalne lineaarne kiirendi) abil, pommitades 208Pb poolt 58Usk. 1997. aastal tunnustas Rahvusvaheline Puhta ja Rakenduskeemia Liit (IUPAC) elementi 108 sümboliga Hs. Hassium Saksa Hesseni liidumaa auks.
Hassiumil lahendatud harjutused
küsimus 1
Hassiumi, sümbolit Hs, peetakse kõige raskemaks elemendiks, mille omadusi on eksperimentaalselt uuritud. Sel ajal suutsid teadlased määrata hasiumtetroksiidi, HsO omadused4. Selles liigis on Hs sama NOx kui selle rühma kergematel elementidel, osmium (Os) ja ruteenium (Ru). Hs oksüdatsiooniarv hasiumtetroksiidis on võrdne:
a) 0
B) +2
C) +4
D) +6
E) +8
Resolutsioon:
Alternatiiv E
THE hapnikku, kui a oksiid, omandab laengu, mis on võrdne -2-ga. Seega NOx Hs, mida me nimetame x-ks, saab arvutada järgmiselt:
x + 4 (-2) = 0
x - 8 = 0
x = +8
küsimus 2
Hassiumi stabiilseima isotoobi Hs poolestusaeg on vaid 14 sekundit. See tähendab:
A) 14 sekundiga on Hs isotoobi mass kahekordistunud.
B) 14 sekundi pärast on Hs isotoobi mass väiksem kui pool algmassist.
C) veidi vähem kui minuti pärast on Hs isotoobi mass 1/16 selle algmassist.
D) ühe minuti pärast on Hs isotoobi mass täpselt pool selle algmassist.
E) 14 sekundi pärast jagatakse Hs isotoobi mass 4-ga.
Resolutsioon:
Alternatiiv C
Poolväärtusaeg näitab aega, mis kulub aatomiliikide hulga poole võrra vähenemiseks. See tähendab, et iga 14 sekundi järel väheneb Hs kogus poole võrra. Seda poolestusaega jälgides on selge, et 56 sekundiga on saavutatud juba neli poolväärtusaega, mis põhjustab H massi jagamise 2-ga4, mis on 16.
Autor Stefano Araújo Novais
Keemia õpetaja
