Hape on mis tahes aine, mis ioniseerub vee juuresolekul ja pärineb ühe ioonina H+ katioonist. Happeid saab klassifitseerida mitme kriteeriumi alusel, sealhulgas:
ionisatsiooni aste: on tähistatud sümboliga α ja see vastab ioniseeritavate molekulide arvu ja lahustunud molekulide koguarvu suhtele. Näide: igast 100 lahustatud HCl (vesinikkloriidhappe) molekulist ioniseerub 92 molekuli.
Volatiilsus: see kriteerium klassifitseerib happed selle järgi, kuidas on lihtne vedelast gaasiliseks muutuda, need võivad olla lenduvad või fikseeritud:
lenduvad: enamik happeid on lenduvad. Näide: äädikapudeli avades märkame peagi sellele iseloomulikku lõhna. Seda seetõttu, et äädikas sisalduv äädikhape on väga lenduv hape.
Parandatud: on vähelenduvad happed, levinuim näide on väävelhape.
Svante Arrehenius oli Rootsi keemik, kes 1887. aastal viis läbi arvukalt katseid vees lahjendatud ainetega ja lõi ülaltoodud määratluse ning tegi isegi mõningaid tähelepanekuid hapete kohta:
- Vesilahuses olles juhivad happed elektrit. Seda seetõttu, et happed lagunevad ioonideks.
- Happed ioniseeruvad vesilahuses, st tekitavad ioone ja H+ katiooni.
- Neutraliseerimisreaktsioonides reageerivad happed alustega, moodustades soolasid ja vett.
Muud hapete omadused:
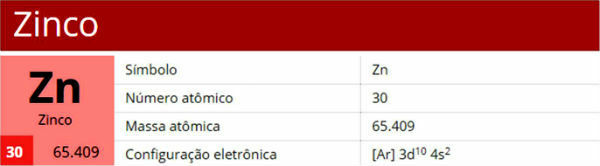
Reaktsioon metallidega: Happed võivad reageerida paljude metallidega, tekitades seega gaasilise vesiniku (H2) ja metallisoola. Tsink ja vesinikkloriidhape reageerivad üksteisega, seda reaktsiooni saab esitada võrrandiga:
Ära nüüd lõpeta... Peale reklaami on veel midagi ;)
Zn (s) + 2 HCl (vesi) → ZnCl2 (aq) + H2 (g)
Reaktsioon karbonaatide ja vesinikkarbonaatidega: reageerimisel hapetega, karbonaatidest saadud anioonidega (CO2-3-) ja vesinikkarbonaadid (HCO3-) eraldavad süsinikdioksiidi. Vaata reaktsiooni:
CaCO3 (s) + 2 HCl (vesi) → CaCl2 (aq) + H2O(1) + CO2 (g)
Karbonaat
kaltsiumist
Näitajatega seotud tegevus: Happed muudavad teatud ainete, mida nimetatakse indikaatoriteks, värvi, need muudavad värvi sõltuvalt sellest, kas keskkond on happeline või aluseline. Kõige levinumad näitajad on lakmus ja fenoolftaleiin. Punane fenoolftaleiini lahus muutub happe juuresolekul värvituks. Sinine lakmuspaber muutub punaseks.
Autor Líria Alves
Lõpetanud keemia eriala
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
SOUZA, Líria Alves de. "Hapete klassifikatsioon ja omadused"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/classificacao-propriedades-dos-acidos.htm. Sissepääs 27. juulil 2021.