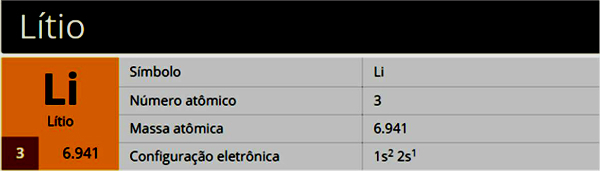
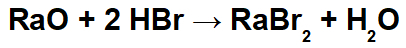Liitium on keemiline element sümboliga Li, aatomnumber 3, aatomimass 7, mis kuulub rühma 1 (perekond 1A) ja on leelismetall.
Selle nimi tuleneb kreeka keelest litod, mis tähendab kivi, kuna elementi leidub kivimites.
Funktsioonid
Kuna see on väga reaktiivne element, ei leidu seda looduses eraldi. Puhtal kujul oksüdeerub see õhu või vee juuresolekul kergesti.
Seda leidub mineraalides spodumene, lepidoliit ja petaliit. Lisaks kividele esineb seda ka soolases ja termaalses vees. Tööstuskeskkonnas saadakse see liitiumkloriidi elektrolüüsi teel.
Seda iseloomustab pehme, pehme ja hõbedane metall. Õhuga kokkupuutel omandab see halli värvi, mistõttu on tavaline, et seda hoitakse mineraalõlis.
Muude funktsioonide hulgas on:
- Hea elektrijuht;
- Äärmiselt reaktiivne;
- Väga tuleohtlik;
- Väiksema tihedusega metall on veelgi vähem tihe kui vesi.
Lisateave, lugege ka:
- Keemilised elemendid
- Perioodilisustabel
rakendused
Liitiumil on erinevat tüüpi kasutusala, alates tööstuslikest rakendustest kuni ravimite tootmiseni:
- Patareide tootmine liitiumioonidest;
- Osaleb südamestimulaatorite töös;
- Liitiumkarbonaati kasutatakse psühhiaatriliste ravimite koostises, näiteks bipolaarse depressiooni ja rahustite vastu;
- Osaleb metallisulamite moodustamisel;
- Kõrgel temperatuuril töötavate masinate määrdeainete tootmine;
- Kuumuskindla keraamika ja klaasi tootmine;
- Tööstuslikud kuivatussüsteemid liitiumkloriidi või bromiidi kujul.
Loe ka teiste keemiliste elementide kohta:
- Baarium
- Fosfor
- Heelium