kutsutakse Rutherfordi mudel teadlase Ernest Rutherfordi 1911. aastal aatomi kohta tehtud ettepanek eesmärgiga demonstreerida mateeria koostisosa idealiseeritud kuju ja koostist: aatom.
O Rutherfordi mudel seda tuntakse üldiselt päikesesüsteemi mudelina, kuna selle ehitust ja toimimist on võrreldud päikese ja selle ümber tiirlevate planeetide vaheliste suhetega.
Oma mudelis võrdles Rutherford päikest aatomi tuumaga ja aatomi elektrone Päikesesüsteemi planeetidega, nagu on näha järgmisest esitusest:
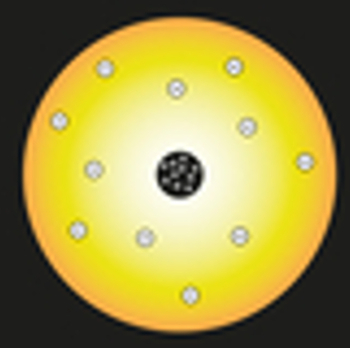
Rutherfordi aatomimudeli esitus
Tuuma sees paikneksid positiivselt laetud osakesed, mida nimetatakse prootoniteks (avastas Eugen Goldstein). See tuum oleks väike ja tihe ning sellel oleks aatomi suurim mass.
Rutherfordi läbiviidud katse
Kõik Rutherfordi ettepanekud oma aatomimudeli loomiseks tulenesid katsest, mille käigus ta fokuseeris alfa-kiirguse kiired (pärineb pliikarbis olevast radioaktiivsest polooniumist) õhukesel kuldplaadil, mille taga ja külgedel on tsinksulfiidiga kaetud metallplaat. küljed. Tsinksulfiid on sool, mis kiirgust saades särab.
Seejärel märkis Rutherford, et selle katse ajal särasid eriti kolm punkti (a, b, c):
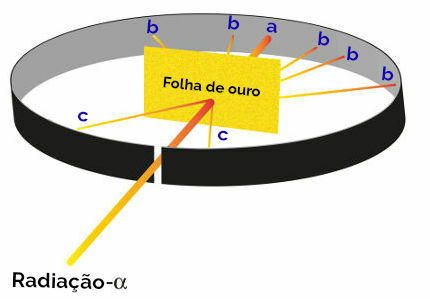
Rutherfordi eksperimendi esitus
punkt a (suurem läike esinemissagedus): näitas, et alfa-kiirgus ületas kuldplaadi probleemideta, kuna see oleks pliiploki avanemise suunas;
punkt b (väike kuma): näitas, et alfa-kiirgus ületas kuldplaadi, kuid see oleks ristumise ajal kõrvale kaldunud;
punkt c (äärmiselt väike kogus sära): asub kuldse tera ees, andis märku, et alfakiirgus ei läinud läbi.
Rutherford omistas need täheldatud tulemused aatomitele, mis moodustavad kuldplaadi, tõlgendades järgmiselt:
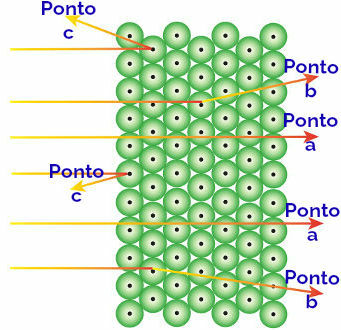
Alfakiirguse ja aatomite käitumise kujutamine
Alfa kiirgus, mis jõuab osutada: alfakiirgus on positiivne ja läbib tohutute tühjade ruumide aatomi piirkonda. Mõnel orbitaalil on ka elektrone.
Alfa kiirgus, mis jõuab punkt b: alfakiirgus läbib kuldplaadi aatomeid, kuid jõuab teatud hetkeni, mil see läbib aatomi väikese tuuma lähedalt, mis on positiivselt laetud, tekitades aatomis tõrjumise. kiirgus.
Alfa kiirgus, mis jõuab punkt c: alfakiirgus läbib kuldplaadi aatomeid, kuid see tabab väikest tuuma, mis on positiivselt laetud, tekitades kiirguses tõrjumise.
Rutherfordi mudeli problemaatika
Paljud füüsikud tõid välja mõned probleemid Rutherfordi pakutud mudelis:
1. probleem: kuidas oleks võimalik positiivselt laetud tuum, kui positiivselt laetud osakesed üksteist tõrjuvad?
2. probleem: miks ei tõmba elektrosfäärides olevaid elektrone tuumas olevad prootonid?
3. probleem: miks elektronid, mis on pidevas liikumises väikesed kehad, ei kaota energiat ja ei kuku tuuma?
* Pildi tiitrid: Svic / Shutterstock
Mina. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-modelo-rutherford.htm
