Kp on akronüüm, mida kasutatakse määramiseks tasakaalu konstant osarõhkude osas. See konstant töötab näiteks atm-ühiku tasakaalus olevate gaasiliste osalejate väärtustega.

Võrrand, mis kujutab keemilist reaktsiooni gaasiliste komponentidega
Selles võrrandis on kõik osalejad gaasilised, nii et kui osaleval gaasil on a osaline rõhk segus, seda tähistab lühend pX.
Keemilise tasakaalu võrrandi koostamisel (kontsentratsiooni mõttes) tuleb produktid paigutada lugejasse ja reagendid nimetajasse:
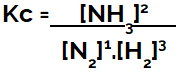
Ammoniaagi moodustumise tasakaalu Kc ekspressioon
väljendus tasakaalukonstant rõhuna (Kp) järgib mustrit Kc, see tähendab, et reaktiivide osarõhud on paigutatud nimetajasse ja toodete osarõhud lugejasse:
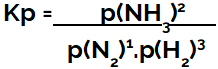
Ammoniaagi moodustumise tasakaalu Kp ekspressioon
Vaatlus: Kui reaktsioonivõrrand keemiline tasakaal ärge esitage ühtegi gaasilist osalejat, see ei esine automaatselt Kp.
Näide: (PUC-MG) Reaktsiooni jaoks: 2 CO(g) + O2(g)? 2 CO2(g), CO osarõhud(g) see on2(g) tasakaaluolekus on need vastavalt 0,2 atm ja 0,4 atm. Süsteemi kogurõhk on 1,4 atm. Väärtus Kp sest reaktsioon on:
a) 56.2
b) 40,0
c) 35.6
d) 28.4
e) 25.6
Treeningu andmed on järgmised:
Süsinikmonooksiidi osarõhk (pCO) = 0,2 atm;
Süsinikmonooksiidi osarõhk (pO2) = 0,4 atm;
Üldrõhk =1,4 atm;
Selle süsteemi Kp määramiseks peame tegema järgmised toimingud:
1. samm: Määrake süsinikmonooksiidi osarõhk (pCO2).
Selleks pidage meeles, et kogurõhk (pt) on kõigi osarõhkude summa:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4-0,2-0,4 = pCO2
pCO2 = 0,8 atm
2. samm: Määrake harjutuse Kp.
Selleks kasutage lihtsalt tasakaalukonstandi Kp avaldis olevaid väärtusi:
Kp = (pCO2)2
(pCO)2.(tolm2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Mina. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm

