Aatomimudelid tulid välja vajadusest selgitada aatomite struktuuri. Kui esitati uusi tõendeid aatomite konstitutsiooni kohta, proovis leiud selgitada uus aatomimudel.
Kreeka filosoofid Democritus ja Leucipo V sajandil; Ç. nimetatakse kreeka keelest aatomiks ατoμoν, aine jagamatu osake ja väikseim osa.
Ehkki aatomi mõiste on vana, pärinevad aatomiteooriad 19. ja 20. sajandist. Seetõttu olid aine olemuse mõistmiseks välja töötatud peamised aatomimudelid järgmised:
- Daltoni aatomimudel (1803) - piljardikuulimudel
- Thomsoni aatomimudel (1898) - "Vihmapudeli mudel"
- Rutherfordi aatomimudel (1911) - "tuumamudel"
- Bohri aatomimudel (1913) - "planeedimudel"
- Kvantatomi mudel (1926) - "elektrooniline pilvemudel"

Daltoni aatomimudel
Esimene tunnustatud katse kirjeldada aatomeid tuli inglise teadlaselt John Daltonilt (1766-1844) mudeli järgi, mida rahvasuus tuntakse kui “piljardipalli”.
Daltoni aatom (1803): massiivne, jagamatu ja hävimatu sfäär.

Daltoni sõnul:
- Kõik ained moodustuvad aatomitest;
- Keemilise elemendi aatomid on suuruse ja omadustega identsed, samas kui erinevate keemiliste elementide aatomid on erinevad;
- Ained on keemilise reaktsiooni tulemus, mis seisneb aatomite rekombinatsioonis.
Negatiivsed punktid: Kuna Daltoni oma teooria formuleerimisel ei olnud elektronid veel teada, ei võetud arvesse neid osakesi, mis praegu on aatomite osad.
Lisateave Daltoni aatomimudel.
Thomsoni aatomimudel
Joseph John Thomson (1856-1940) vastutas elektronide, negatiivse laenguga varustatud osakeste ja aatomite osa avastamise eest. See avastus lükkas ümber Daltoni aatomiteooria, mille kohaselt aatom on jagamatu, kuid moodustub veelgi väiksematest osakestest ja seetõttu sai see nimeks “rosinapuding”.
Thomsoni aatom (1898): fikseeritud elektronidega positiivselt laetud kera.

Thomsoni sõnul:
- Aatom on elektriliselt neutraalne;
- Elektronid kinnituvad positiivselt laetud pinnale;
- Aatomites jaotunud elektronide vahel on tõrjumine.
Negatiivsed punktid: Kuigi Thomson võttis arvesse elektronide olemasolu, ei ole aatom positiivne sfäär, vaid pigem varustatud positiivselt laetud osakesed, prootonid, mille 1886. aastal tuvastas teadlane Eugene Goldstein ja hiljem kinnitas ka Ernest Rutherford.
Lisateave Thomsoni aatomimudel.
Rutherfordi aatomimudel
Oma katsete abil õnnestus Ernest Rutherfordil (1871–1937) näidata, et aatom ei olnud jagamatu osake, nagu arvati, vaid et selle moodustasid väiksemad osakesed.
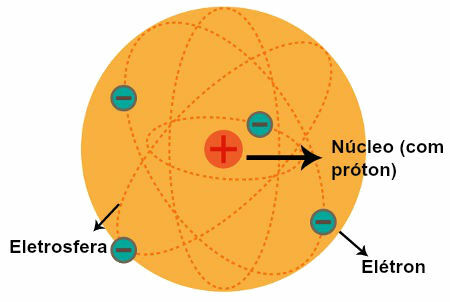
Rutherfordi aatom (1911): positiivselt laetud tuum ja elektronid asuvad selle ümber elektrosfääris.

Rutherfordi sõnul:
- Aatomil on kõrge positiivse laengu kontsentratsiooniga keskne piirkond;
- Aatomi mass on koondunud selle keskmisse piirkonda;
- Elektronid on kergemad ja asuvad tuuma ümber - piirkonnas, mis sisaldab palju tühje kohti.
Negatiivsed punktid: aatomituumas ei ole ainult positiivselt laetud osakesi, vaid on ka teisi subatomaalseid osakesi, neutrone, mille avastas James Chadwick 1932. aastal. Pealegi ei selgitanud Rutherfordi pakutud mudel aatomite valguse kiirgust.
Lisateave Rutherfordi aatomimudel.
Bohri aatomimudel
Püüdes selgitada, miks elemendid teatud tingimustega kokkupuutel ja selle põhjal eritavad iseloomulikke värve Rutherfordi aatomimudel, Niels Bohr (1885-1962) pakkus välja aatomiteooria, mis selgitas valguse emissiooni teatud sagedused.
Bohri aatom (1913): elektronid liiguvad tuuma ümber fikseeritud ümmarguste kihtidena.

Bohri sõnul:
- Elektronid liiguvad tuuma ümbritsevates kihtides;
- Tuuma ümbritsevatel kihtidel on spetsiifilised energiaväärtused;
- Välisemale tasandile minekuks peab elektron neelama energiat. Tuumale lähemale kihile naastes vabastab elektron energiat.
Negatiivsed punktid: Ei saa öelda, et elektronid liiguksid tuuma ümber fikseeritud asendites nagu planeedid ümber Päikese.
Lisateave Bohri aatomimudel.
Kvant-aatomimudel
Paljud teadlased on aidanud kaasa kvantmehaanika väljatöötamisele, mis püüab selgitada a-i "tõelisemat" struktuuri aatom mitmete uuringute kombineerimisega ja seetõttu on see kõige keerukam.
Kvant-aatom (1926): tuum koosneb prootonitest (positiivne laeng) ja neutronitest (nulllaeng) ja elektronid (negatiivne laeng) moodustavad tuuma ümber elektroonilise pilve.

Kvant aatomimudeli järgi:
- Tuum koosneb prootonitest ja neutronitest. Kuna ainult prootonitel on laeng, on tuum positiivselt laetud;
- Elektronid moodustavad tuuma ümber elektroonilise pilve;
- Elektronid liiguvad orbitaalides, kolmemõõtmelises ruumis;
- Elektroni täpset asukohta ei saa määratleda. Tehakse arvutusi, mis määravad piirkonna tõenäosuse, et elektron teatud aja jooksul viibib.
Sina kvantarvud on elektronide asukoha funktsioon. Kas nad on:
O peamine kvantarv (n) tähistab energiatasemeid, see tähendab aatomi elektroonilisi kihte.
O sekundaarne kvantarv (l) tähistab energia alatasemeid, see tähendab energia alatasemeid, kuhu elektron kuulub.
O magnetiline kvantarv (m) on see, mis näitab orbiiti, kus elektronid kohtuvad.
Lisateave aatomimudelid ja proovige oma teadmisi harjutused aatomimudelitel.