Katsed on praktiline viis õppida ja testida oma teadmisi keemias õpitud mõistetest.
Kasutage oma õpingute täiendamiseks ära neid keemilisi eksperimente, mida saab teha kodus (täiskasvanute järelevalve all) või töötada koos klassis koos õpetajaga.
1. kogemus - värvide lahti harutamine
Kaasatud mõisted: kromatograafia ja segude eraldamine
Materjalid
- mitmevärvilised markerpliiatsid
- alkohol
- kohvi filterpaber
- tass (klaas katse jälgimise hõlbustamiseks)
Kuidas teha
- Kasutage käärid ja lõigake filterpaberi ribad. Tehke iga kasutatud pliiatsi jaoks ristkülik.
- Nüüd tõmmake alusest umbes 2 cm kaugusele valitud värvipliiatsiga ring ja värvige kogu sisemus.
- Kleepige paberi serv tõmmatud marmorist kõige kaugemale toele. Selleks saate kasutada linti ja kinnitada see pliiatsi külge.
- Lisage klaasile alkoholi, mitte liiga palju, sest see peaks lihtsalt puudutama paberi otsa pliiatsi märgi lähedal.
- Asetage paber tassi nii, et see oleks vertikaalne. Seda toetav pliiats peaks toetuma servadele.
- Oodake 10–15 minutit, kuni alkohol tõuseb läbi filterpaberi. Pärast seda eemaldage paberid ja laske neil kuivada.
Tulemus
Kui alkohol läheb pastakamärgist mööda, suhtleb see värvikomponentidega ja ajab need üle paberi. Seega eraldatakse erinevad pigmendid kokkupuutel alkoholiga.
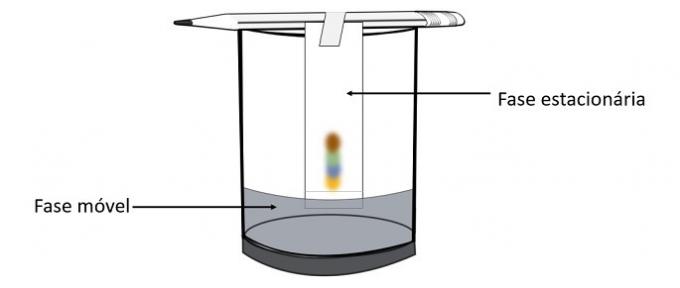
Selle katse kaudu on võimalik teada saada, milliseid värve pliiatsi värvi loomiseks segati.
Selgitus
Kromatograafia on teatud tüüpi protsess segude eraldamiseks. Filtripaber on statsionaarne faas ja alkohol on liikuv faas, mis lohistab segu komponente statsionaarset faasi läbides. Selles protsessis, mida suurem on interaktsioon alkoholiga, seda kiiremini liigub pigment lahusti möödumisel.
Materjali koostisosad, kuna neil on erinevad omadused, suhtlevad liikuva faasiga erineval viisil, mida statsionaarse faasi erinevad lohistusajad võivad märgata.
Lisateave kromatograafia.
2. kogemus - toidu säilitamine
Kaasatud mõisted: orgaanilised ühendid ja keemilised reaktsioonid
Materjalid
- õun, banaan või pirn
- sidruni- või apelsinimahl
- C-vitamiini tablett
Kuidas teha
- Valige üks kolmest puuviljast ja lõigake see 3 võrdsesse ossa.
- Esimene tükk on võrdluseks teistega. Nii et ärge lisage sellele midagi, jätke see lihtsalt õhku.
- Tilgutage ühte tükki sidruni või apelsini sisu. Laota nii, et kogu puuvilja sisemus oleks mahlaga kaetud.
- Viimases osas levitage C-vitamiini, see võib olla purustatud tablett kogu viljalihas.
- Vaadake, mis juhtub, ja võrrelge tulemusi.
Tulemus
Õhuga kokku puutunud puuvilja viljaliha peaks kiiresti tumenema. Sidruni- või apelsinimahl ja C-vitamiin, kemikaal nimega askorbiinhape, peaksid vilja pruunistumist pidurdama.

Selgitus
Kui me lõikame puuvilja, on selle rakud kahjustatud, vabastades ensüüme, näiteks polüfenooloksüdaasi, mis kokkupuutel õhuga oksüdeerivad toidus sisalduvad fenoolühendid ja põhjustavad ensümaatilist pruunistumist.
Hapniku toime vältimiseks kasutatakse säilitusaineid nagu askorbiinhape, kuna need oksüdeeritakse eelistatavalt fenoolühendite asemel. Lisaks C-vitamiini tabletile on askorbiinhapet ka looduslikes allikates, näiteks katses soovitatud tsitruselistes, sidrunis ja apelsinis.
Lisateave oksüdeerumine.
3. kogemus - kes külmub kiiremini?
Kaasatud mõisted: kolligatiivsed omadused ja krüoskoopia
Materjalid
- kaks toru (kasutatakse peo soosimiseks)
- klaasist kauss
- lauasool
- filtreeritud vesi
- jää
- termomeeter
Kuidas teha
- Lisage mõlemasse torusse sama kogus filtreeritud vett. Näiteks 5 ml igas tuubis.
- Lisage ühele torule lauasool ja asetage identifitseerimislint, et eristada soolast.
- Täitke klaasanum purustatud jääga ja lisage veidi soola.
- Asetage kaks toru üheaegselt jäässe ja jälgige, mis juhtub.
- Registreerige iga olukorra jaoks külmumistemperatuur.
Tulemus
Soluudi lisamine vette alandab külmumistemperatuuri. Seetõttu kipub tavaline vesi samade tingimuste mõjul külmuma palju kiiremini kui soola ja vee lahus.
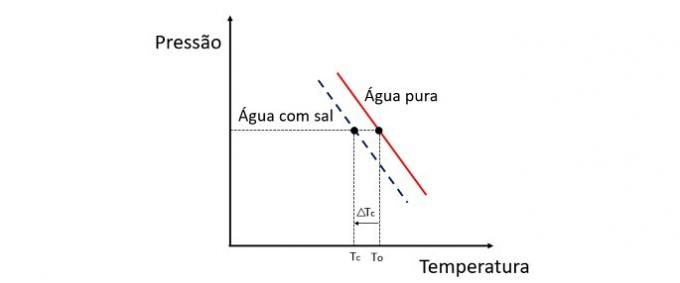
Selgitus
Krüoskoopia on kolligatiivne omadus, mis uurib lahusti temperatuuri varieerumist, kui selles lahustatakse erinevaid koguseid soluuti.
Vee külmumistemperatuuri langetamine on põhjustatud mittelenduvast lahustunud ainest ja sellel nähtusel on palju praktilisi rakendusi. Seetõttu mõjutab lahuse suurem kontsentratsioon lahuses krüoskoopilist efekti.
Kui näiteks vesi külmub 0 ° C juures ja lisame sellele soola, on faasimuutuse temperatuur negatiivne, st palju madalam.
Seetõttu ei külmuta merevesi kohtades, mille temperatuur on alla 0 ° C. Vees lahustunud sool kipub külmumistemperatuuri veelgi alandama. Kohtades, kus on lund, on tavaline ka teele soola viskamine, et jää sulatada ja õnnetusi vältida.
Lisateave kolligatiivsed omadused.
4. katse - vesinikperoksiidi lagunemine
kaasatud mõisted: keemiline reaktsioon ja katalüsaator
Materjalid
- Pool toorest kartulit ja pool keedetud
- Tükk toorest maksa ja teine keedetud tükk
- Vesinikperoksiidi
- 2 rooga
Kuidas teha
- Igasse rooga lisage toit, kartulid koos maksaga.
- Igasse neljast materjalist lisage 3 tilka vesinikperoksiidi.
- Vaadake, mis juhtub, ja võrrelge tulemusi.
Tulemus
Toortoiduga kokkupuutel olev vesinikperoksiid, vesinikperoksiidi lahus, hakkab peaaegu koheselt kihisema.
Selle katse saab läbi viia ka toidutüki lisamisega vesinikperoksiidiga mahutisse, et reaktsioon oleks paremini märgatav.
Selgitus
Toortoiduga kokkupuutel tekkiv vesinikperoksiidi kihisemine iseloomustab keemilise reaktsiooni toimumine, milleks on vesinikperoksiidi lagunemine ja gaasi eraldumine hapnik.
Vesinikperoksiidi lagunemine toimub looma- ja taimerakkudes leiduva peroksisoomi organellides leiduva katalaasi ensüümi toimel.
Oluline on märkida, et vesinikperoksiidi lagunemine toimub spontaanselt, päikesevalguse käes, kuid väga aeglaselt. Kuid katalaas toimib katalüsaatorina, suurendades keemilise reaktsiooni kiirust.
Vesinikperoksiid võib olla rakkudele toksiline aine. Seetõttu lagundab katalaas ühendi ja toodab vett ja hapnikku - kahte ainet, mis ei kahjusta keha.
Toidu valmistamisel muutuvad selle komponendid. Keetmise põhjustatud modifikatsioonid kahjustavad ka valgu denatureerimise kaudu katalaasi toimet.
Sama tegevus, mida näeme toiduga, juhtub siis, kui paneme haavale vesinikperoksiidi. Katalaas toimib ja tekib mullide moodustumine, mis seisneb hapniku eraldamises.
Lisateave keemilised reaktsioonid.
Bibliograafilised viited
PÜHAD, W. L. P.; MOL, G. S. (Koordendid.). Kodanike keemia. 1. toim. São Paulo: uus põlvkond, 2011. v. 1, 2, 3.
Brasiilia keemiaühiskond (org) 2010. Keemia teie lähedal: K-12 klassiruumi odavad katsed. 1. toim. Sao Paulo.

