Sulamistemperatuur ja keemistemperatuur tähistavad temperatuuri, mille juures aine teatud rõhu juures olekut muudab.
Sulamistemperatuuri korral muutub aine tahkest olekust vedelaks. Keemistemperatuur viitab muutusele vedelas olekus gaasiliseks olekuks.
Näiteks hakkab jää vedelal kujul veeks muutuma, kui selle temperatuur on võrdne 0 ° C-ga. Seega on vee sulamistemperatuur 0 ° C (1 atmosfääri rõhu all).
Vedelast auruks muutmiseks peab vesi saavutama 100 ° C temperatuuri. Seega on vee keemistemperatuur 100 ° C (1 atmosfääri rõhu all).

Sulandumispunkt
Kui tahkis aine saab kuumus, suureneb selle molekulide segamise aste. Järelikult tõuseb ka selle temperatuur.
Teatud temperatuuri (sulamistemperatuuri) saavutamisel on molekulide segamine selline, et nad lõhuvad sisemised sidemed aatomite ja molekulide vahel.
Siinkohal hakkab aine oma olekut muutma ja läheb vedelasse olekusse, kui jätkab soojuse saamist.
Jooksul Fusioon selle temperatuur püsib konstantsena, kuna saadud soojust kasutatakse ainult oleku muutmiseks.

Faaside vahetamiseks vajalikku soojust massiühiku kohta nimetatakse varjatud kuumus termotuumasünteesi (Lf) ja on aine omadus.
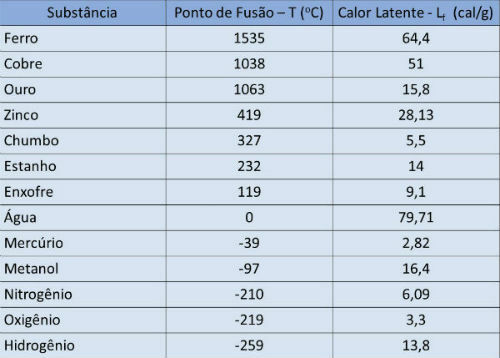
Sulamistemperatuur ja varjatud kuumalaud
Alljärgnevas tabelis esitame sulamistemperatuuri ja mõnede ainete varjatud kuumuse kuni atmosfääri rõhk.
Keemispunkt
THE keemine seda iseloomustab vedeliku kiire liikumine gaasilisse olekusse, kusjuures vedeliku sees moodustuvad aurud (mullid).
Nagu sulandumisel, on ka temperatuur (keemistemperatuur), mille juures antud aine muutub vedelast gaasiliseks.
Selle tekkimiseks peab aine saama soojust. Kogu faasimuutuse ajal püsib temperatuur konstantsena.
varjatud kuumus aurustamine (Lv) on aine faasi muutmiseks vajalik soojushulk massiühiku kohta.
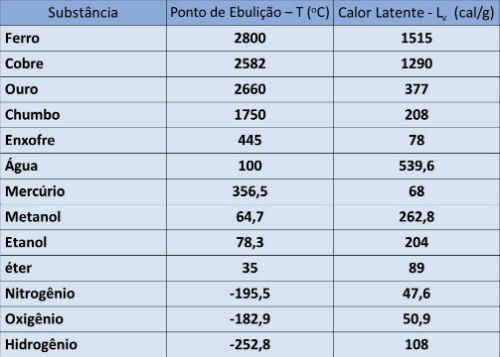
Keemispunkt ja varjatud kuumalaud
Alljärgnevas tabelis esitame mõnede ainete keemistemperatuuri ja varjatud aurustumissoojuse õhurõhul.
Rõhuhäired
Sulamistemperatuuri ja keemistemperatuuri temperatuur sõltub ainele avaldatavast rõhust.
Üldiselt suureneb ainete maht sulandumisel. See asjaolu tähendab, et mida kõrgem on rõhk, seda kõrgem on aine faasi muutmise temperatuur.
Erand esineb mõnede ainete, sealhulgas vee puhul, mis sulamisel vähendab selle mahtu. Sellisel juhul alandab kõrgem rõhk sulamistemperatuuri.

Rõhu langus põhjustab antud aine keemistemperatuuri madalama, see tähendab, et aine keeb madalamal temperatuuril.
Näiteks merepinnast kõrgemal asuvates kohtades keeb vesi temperatuuril alla 100 ° C. Seetõttu võtab nendes kohtades küpsetamine palju kauem aega kui merepinnal.
Loe ka:
- Füüsikalise seisundi muutused
- Termomeetrilised kaalud
- Termomeetrilised kaalud - harjutused
- Vee füüsikalised olekud
- Faaside skeem
- Tahkumine
- Kondensatsioon
- Kollektiivsed omadused
- Perioodilised omadused
- Aurustamine
- Harjutused perioodilisustabelis