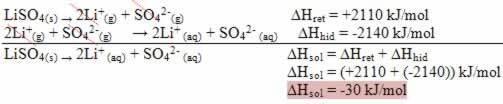
Lahustatud aine ja lahusti on keemilise lahuse nimega homogeense segu kaks komponenti.
- Soluut: on aine, mis on lahustis dispergeeritud. See vastab lahustuvale ainele ja esineb lahuses üldiselt väiksemas koguses.
- Lahusti: on aine, milles lahustunud aine lahustatakse uue toote moodustamiseks. See on lahuses suuremas koguses.
Lahustunud aine (dispergeeritud) ja lahusti (dispergeerija) vahel toimub nende molekulide vastastikmõjude kaudu.
Lahuse nende kahe komponendi erinevus seisneb selles, et soluut on aine, mis lahustub, ja lahusti on aine, mis põhjustab lahustumist.
Tuntum lahusti on vesi, mida peetakse lahuseks universaalne lahusti. Seda seetõttu, et see suudab lahustada suures koguses aineid.
Lahusti ja lahusti näited
Vaadake mõningaid keemiliste lahuste näiteid ja avastage igaühe lahused ja lahustid:
Vesi ja sool
- Lahustatud aine: lauasool - naatriumkloriid (NaCl)
- Lahusti: vesi
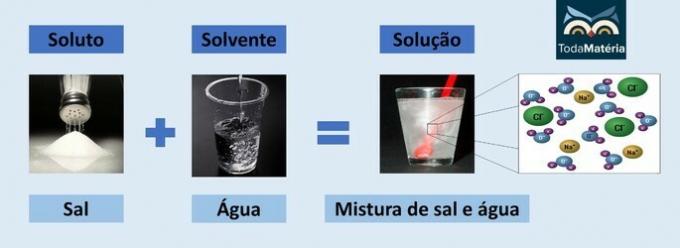
Kuna tegemist on ioonse ühendiga, siis lahuses sisalduv naatriumkloriid dissotsieerub ja moodustab ioone, mille omakorda solvateerivad Vesi.
Vee positiivne poolus (H+) interakteerub soola aniooniga (Cl-) ja vee negatiivne poolus (O2-) suhtleb katiooniga (Na+).
See on teatud tüüpi elektrolüütiline lahus, kuna lahuses olevad ioonsed liigid on võimelised juhtima elektrivoolu.
vesi ja suhkur
- Soluut: suhkur - sahharoos (C.12H22O11)
- Lahusti: vesi

Suhkur on kovalentne ühend ja vees lahustatuna molekulid nad hajuvad, kuid ei muuda oma identiteeti.
See vesilahus klassifitseeritakse mitteelektrolüütiliseks, kuna lahuses dispergeeritud soluut on neutraalne ega reageeri seetõttu veega.
Äädikas
- Soluut: äädikhape (CH3COOH)
- Lahusti: vesi

Äädikas on lahus, mis sisaldab vähemalt 4% äädikhapet, a karboksüülhape mis polaarselt olles reageerib vesiniksidemete kaudu ka veega, ka polaarselt.
Lahustuvuse oluline reegel on see, et sarnased lahustavad sarnased. Polaarsed ühendid lahustatakse polaarsetes lahustites, mittepolaarsed ained lahustuvad mittepolaarsetes lahustites.
Muud lahendused
Lisaks vedelatele lahustele on ka gaasilisi ja tahkeid lahuseid.
Õhk, mida hingame, on näide gaasilisest lahusest, mille gaasid on suuremas koguses lämmastik (78%) ja hapnik (21%).
Kell metallisulamid need on kindlad lahendused. Näiteks messing (tsink ja vask) on segu, mida kasutatakse muusikariistade valmistamiseks.
Kas soovite saada rohkem teadmisi? Nii et lugege neid teisi tekste:
- Keemilised lahendused
- molekulidevahelised jõud
- Homogeensed ja heterogeensed segud
Mis on lahustuvuskoefitsient?
Lahustuvuskoefitsient on lahustile antud temperatuuril lisatava lahustunud aine moodustamiseks küllastunud lahuse moodustumise piir.
O lahustuvuskoefitsient varieerub vastavalt tingimustele ning võib vastavalt temperatuuri ja kõnesoleva aine muutustele suureneda või väheneda.
Lahusti lahustumiseks on piir.
Näide: Kui panete suhkru veeklaasi, märkate esimesel hetkel, et suhkur kaob veest.
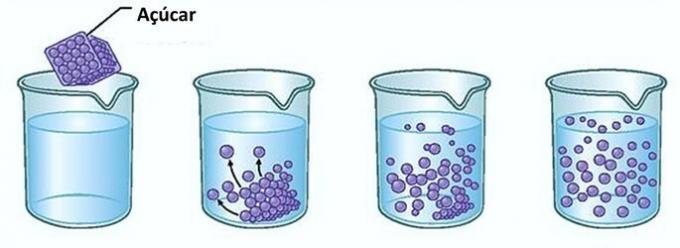
Kui aga jätkate suhkru lisamist, leiate, et ühel hetkel hakkab see klaasi põhja kogunema.
Seda seetõttu, et lahusti vesi on jõudnud piirini lahustuvus ja maksimaalne kontsentratsiooni suurus. Nimetatakse lahustunud aine, mis jääb anuma põhja ja ei lahustu taustkere.
Liigne suhkur klaasi põhjas ei lahustu ega mõjuta lahuse kontsentratsiooni. Pealegi ei tee klaasi põhja ladestunud suhkur vett magusamaks.
Lahuste klassifikatsioon
Lahuseid saab liigitada lahustunud aine koguse järgi. Seega võivad need olla kolme tüüpi: küllastunud, küllastumata ja üleküllastatud.
- küllastunud lahus: Lahus on jõudnud lahustuvuskoefitsiendi piirini, see tähendab, et lahustis on teatud temperatuuril lahustunud maksimaalne kogus lahustunud ainet.
- küllastumata lahus: Lahustatud lahustunud aine kogus ei ole veel jõudnud lahustuvuskoefitsiendini. See tähendab, et lahustunud ainet saab lisada rohkem.
- üleküllastunud lahus: Lahustunud lahustunud ainet on rohkem kui tavalistes tingimustes. Sel juhul moodustavad nad sade.
Lahenduste kohta lisateabe saamiseks lugege järgmisi tekste.:
- Lahuste lahjendamine
- Molaalsus
- Molaarsus
- Tiitrimine
Lahuste kontsentreerimine
Soluudi ja lahusti põhjal on võimalik arvutada lahuse kontsentratsioon.
Tavaline kontsentratsioon on määratletud kui antud lahuse mahus lahustunud soluudi massi suhe.
Kontsentratsiooni arvutamisel kasutatakse järgmist valemit:
Olemine,
Ç: Kontsentratsioon (g / l);
m: lahustunud aine mass (g);
V: lahuse maht (L).
Näide:
(Faap) Arvutage 30 g soola sisaldava naatriumnitraadi vesilahuse kontsentratsioon g / l 400 ml lahuses:
Resolutsioon:
Järgige teavet lahustunud aine ja lahusti koguste kohta. 400 ml vesilahuses (lahusti) on 30 g soola (soluut).
Kuid maht on milliliitrites ja peame selle teisendama väärtuseks L:
Nüüd peate kontsentratsiooni teadmiseks rakendama valemit:
Selle tulemusega jõudsime järeldusele, et kui segame 30 g soola 400 ml veega, saame lahuse kontsentratsiooniga 75 g / l.
Lisateavet ühise kontsentratsiooni arvutamise kohta on nendest tekstidest abi.:
- Lahuse kontsentratsioon
- Harjutused ühise kontsentratsiooni kohta