Redoksreaktsioonid hõlmavad elektronide ülekannet aatomite, ioonide või molekulide vahel.
Oksüdatsiooni-redutseerimise reaktsioonis toimuvad oksüdeerumisarvu (nox) muutused. Oksüdeerimine koosneb oksüdeerimis- ja redutseerimisprotsessidest:
- Oksüdeerumine: tulemused elektronikaod ja suurenenud nox.
- Reduktsioon: tulemused elektronide võimendus ja vähenenud nox.
Kui üks element loobub elektronidest, võtab teine neid vastu. Seega on vastuvõetud elektronide koguarv võrdne kadunud elektronide koguarvuga.
Redoksreaktsioonide näited põlemisele, korrosioonile ja fotosünteesile.
Näited
Sõltuvalt elemendist, mis elektrone vastu võtab või annetab, on meil järgmised nimed:
- Redutseerija: Oksüdeeruv põhjustab redutseerumist ja suurendab selle arvu. See kaotab elektronid.
- Oksüdeerija: Redutseeritav põhjustab oksüdeerumist ja vähendab selle nox-arvu. See on see, mis saab elektrone.
O oksüdatsiooninumber tähistab elemendi elektrilaengut ajal, mil see osaleb a keemiline side.
See tingimus on seotud elektronegatiivsus, mis on mõnede elementide kalduvus elektrone vastu võtta.
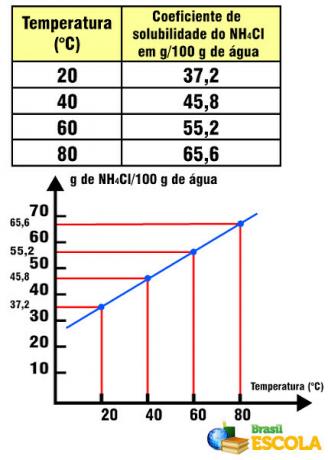
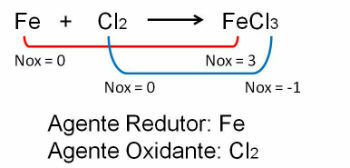
1. Vaadake esimest näidet, pange tähele, et raua ja kloori vahelises reaktsioonis toimub oksüdeerumisarvu muutus. O kloor kuna see on rohkem elektronegatiivne, saab see elektrone:
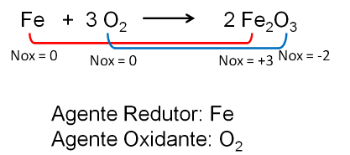
2. Raua ja hapniku reaktsioon. Hapnik on rohkem elektronegatiivne ja jõuab lõpuks elektronideni ja vähendab nende oksüdatsiooninumbrit.
Lisateave, lugege ka:
- Oksüdeerumine
- Põlemine
- Keemilised reaktsioonid
- elektronid
Harjutus lahendatud
1. (PUC-RS) Seoses oksüdatsioonivõrrandiga - tasakaalustamata reduktsioon Fe0 + CuSO4 → Fe2(AINULT4)3 + Cu0, võib öelda, et:
a) vase oksüdatsiooniarv vask sulfaadis on +1.
b) raua aatom kaotab 2 elektroni.
c) vask oksüdeerub.
d) raud on oksüdeeriv aine.
e) raud oksüdeerub.
Resolutsioon:
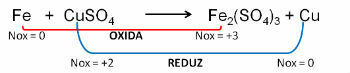
Vastus:
e) raud oksüdeerub.
Harjutused
1. (UFAC-AC) Järgmises keemilises võrrandis: Zn + 2 HCℓ → ZnCℓ2 + H2
a) element Zn oksüdeerub ja reageerib oksüdeeriva ainena.
b) Zn element oksüdeerub ja reageerib redutseerijana.
c) Zn element redutseerib ja reageerib redutseerijana.
d) HC2 on redutseerija.
e) võrrand klassifitseeritakse pöörduvaks.
b) Zn element oksüdeerub ja reageerib redutseerijana.
2. (ITA-SP) Ioonses reaktsioonis Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) nikkel on oksüdeerija, kuna see on oksüdeerunud.
b) nikkel on reduktor, kuna see on oksüdeerunud.
c) vaskioon on oksüdeerija, kuna see on oksüdeerunud.
d) vaskioon on reduktor, kuna see on redutseeritud.
e) see ei ole redoksreaktsioon, seetõttu puudub oksüdeerija ega redutseerija.
b) nikkel on reduktor, kuna see on oksüdeerunud.
3. (UFRGS) Kodumajapidamises kasutatavate pleegitite toimeaine on hüpokloritiioon, ClO-. Valgendamisprotsessides see ioon redutseerub; See tähendab, et:
a) hüpokloriidi toimel toimuv aine võtab vastu elektrone.
b) selle struktuuris on elektronide arv vähenenud.
c) ClO on redutseeriv aine.
d) ClO- muundatakse elementaarklooriks või kloriidiooniks.
e) elektronide ülekannet ei toimu.
d) ClO- muundatakse elementaarklooriks või kloriidiooniks.