Dispersioonid viitavad segudele üldiselt. Näiteks kui segame soola veega või soola ja liiva, saame kaks dispersiooni. Aine, mis on levinud homogeenselt (nagu sool vees) või heterogeenselt (nagu liiv vees), nimetatakse “hajutatuks”. Vesi aga toimib nendel juhtudel dispergeerijana.
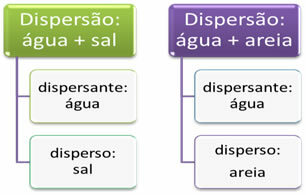
Nende kahe dispersiooni peamine erinevus seisneb dispersiooni osakeste suuruses. Kui liivaterasid on näha palja silmaga, siis soolaosakesed on nähtamatud. Selle põhjal võib dispersioonid jagada kolme põhitüüpi, milleks on:
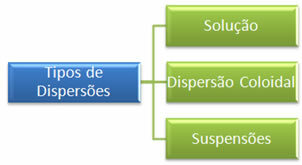
Pange tähele, et allolevas tabelis on hajutatud osakeste suuruse erinevus:

* Lahendused: need on homogeensed segud, milles me ei näe hajunud osakesi isegi mikroskoobi all. Mõned näited on ülalnimetatud sool segatud veega ja ka veega segatud suhkur.
Lahuste puhul nimetatakse dispersiooni lahustunud aineks ja dispergeerivat ainet lahustiks. Lahuseid ei saa eraldada ühegi filtreerimisprotsessiga.
* Kolloidsed või kolloidsed dispersioonid: mõned näited on majonees ja želatiin. Selle osakesi ei visualiseerita palja silmaga, mistõttu neid aetakse sageli segi homogeensete süsteemidega, kuid tegelikult on nad heterogeensed, nagu võib näha ka mikroskoopide kasutamisel. Selle osakesed ei setti gravitatsiooni toimel, vaid ainult ultracentrifuugidega.
Ärge lõpetage kohe... Peale reklaami on veel;)
Kolloidseid dispersioone on mitut tüüpi, milleks on: sool, tahke sool, geel, emulsioon, vaht ja aerosool.
Seda tüüpi dispersiooni eraldamine pole võimalik filtreerimise, vaid poolläbilaskva membraaniga. Selle osakesed peegeldavad ja hajutavad valgust.
* Suspensioonid: need on heterogeensed süsteemid, milles isegi palja silmaga on võimalik nende osakesi visualiseerida. Mõned näited on: liiv vees, savi vees, magneesiumpiim ja kalamiin.
Hajumise korral peegeldub ka valgus. Ja selle eraldamise saab teha ühise filtreerimise teel.

* Kuigi mõned autorid ja teadlased on pakkunud, et kolloidosakeste suurus on vahemikus 1 kuni 100 nm ja suspensioonid on suurem kui 100 nm, kipuvad eksperimentaalsed tõendid seda väärtust suurendama 1000 nm-ni ja enamik aktsepteerib seda väärtust autorid. Kuid selle makroskoopiline käitumine määrab tõesti, kas segu on kolloidne või suspensioon.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Dispersioonide tüübid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/tipos-dispersoes.htm. Juurdepääs 28. juunil 2021.



