Molaarsus (M) on tahke aine (n) ja lahuse mahu (V) suhe, see tähendab M = n / V.
Kuna lahustunud aine on moolides ja maht liitrites, on molaarsuse mõõtühik mol / L.
Seda tuntakse ka nimetustega molaarne kontsentratsioon, kontsentratsioon mol / l või kontsentratsioon aine koguses.
Valem
Molaarsuse valem on:
M = m / M.V
Kus
M = molaarsus
m = lahustunud aine mass (antud grammides)
M = molaarmass (antud g / mol)
V = maht (antud liitrites)
See valem tuleneb asjaolust, et tahke aine on tavaliselt grammides. Seega peame tahke aine (n) saamiseks jagama soluudi mass selle molaarmassiga.
Kuidas arvutada
Lahuse molaarsuse saab arvutada järgmiselt:
1) Näiteks kui teame, et 100 ml lahuses on 0,4 mol soluudi, asendage lihtsalt valemis M = n / V toodud väärtused, st
M = 0,4 / 0,1
M = 4 mol / l
2) Kui nüüd näiteks teame, et 200 ml naatriumhüdroksiidi lahuses on 0,5 mol / l, peame ikkagi teadma, mis on selle mass.
Esiteks peame liitma iga naatriumhüdroksiidi moodustava elemendi massi: naatrium, hapnik ja vesinik. Need väärtused saab perioodilisustabelist (naatrium 23, hapnik 16 ja vesinik 1, 23 + 16 + 1 = 40).
Järgmisena võime kasutada valemit M = m / M. V, see tähendab
M = m / M.V
0,5 = m / 40,0,2
m = 0,5,40,0,2
m = 4 g
Ja molaalsus?
THE molaalsus (W) või molaalne kontsentratsioon tuleneb ka soluudis oleva aine kogusest lahuse mahu kohta.
Molaarsuse eristab molaarsusest see, et molaarsust kasutatakse kõrgemate väärtuste arvutamiseks, alati kilogrammides (kg).
Loe ka:
- Tiitrimine
- Kollektiivsed omadused
- Tihedus
Harjutused
1. (Mack-2004) Cu ioonide molaarsused2+ ja EI 1-3, 0,5 molaarses Cu (NO3)2on vastavalt:
a) 0,5 M ja 0,5 M.
b) 0,5 M ja 1,0 M.
c) 1,0 M ja 1,0 M.
d) 2,0 M ja 0,5 M.
e) 0,5 M ja 1,5 M.
Alternatiiv b) 0,5 M ja 1,0 M.
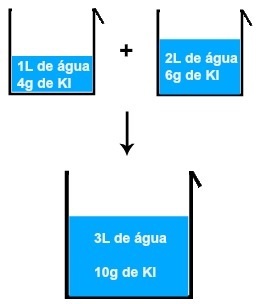
2. (PUC - PR-2007) Ühe õpilase jaoks oli vaja valmistada 0,50 mol / l NaCl vesilahus, et rajada maksimaalne mahuga 80 L mereakvaarium.
Niisiis, segage 25 1 NaCl(siin) 0,40 mol / l, mida oli hoitud gallonis, koos 35 L lahusega teisest deaktiveeritud akvaariumist, mille NaCl kontsentratsioon oli 0,75 mol / l.
Sel viisil saadud lahuse NaCl molaarsus oli:
a) oodatust kõrgem ja selle parandamiseks peaks ta lisama 12 L puhast vett.
b) oodatust madalam ja selle parandamiseks peaks ta lisama 5 L puhast vett.
c) eeldatav väärtus.
d) oodatust suurem ja selle parandamiseks peaks ta lisama 12 L teist 0,40 mol / l NaCl lahust.
e) oodatust madalam ja selle parandamiseks peaks ta lisama 12 L teist 0,40 mol / L NaCl lahust.
Alternatiiv a) on oodatust kõrgem ja selle parandamiseks peaks ta lisama 12 L puhast vett.
3. (UFF-1999) Kaaliumpermanganaati võib kasutada bakteritsiidina põletuste ravis. See on läikiv tahke aine ja seda kasutatakse laborites tavaliselt tavalise reagendina.
Kaaluge 0,395 g selle soola lahustamist happelises keskkonnas piisavalt vees, et saada 250 ml lahust. Saadud lahuse molaarsus on:
a) 0,01 M
b) 0,02 M
c) 0,03 M
d) 0,04 M
e) 0,05 M
Alternatiiv a) 0,01 M
Lahenduste koondamise kohta lisateabe saamiseks vaadake meie koostatud loendit.: Harjutused ühise kontsentratsiooni kohta.