Et saaksite mõista selle nähtust ionisatsioon kõigepealt on vaja teada, mis on ioonid. Pange tähele järgmist selgitust:
Igal aatomil on sama arv prootoneid ja elektrone; seetõttu on iga aatom elektriliselt neutraalne. Lisaks on aatomirühmade poolt moodustatud ainetel ka elektrilaengu tasakaal, olles elektriliselt neutraalne.
Kuid, võib aatom või aatomite rühm kaotada või omandada elektrone; kui see juhtub, kaotavad nad neutraalsuse ja muutuvad ioonideks.
Kui aatom või aatomirühm kaotab elektrone, on see positiivselt laetud ja selleks nimetatakse iooni katioon. Kui aga saate elektrone, on laeng negatiivne ja ioon a anioon.
Anorgaanilised ained on ioonsed või neil on võime ioone moodustada.
Üks ioonide moodustamise viise on molekulaarsete ainete paigutamine vette, see tähendab kovalentsete sidemete abil, milles elektronid on jagatud.
Näiteks kui testime vesinikkloriidhappe (HCl) elektrilist juhtivust vesilahuses (vesinikkloriid vees lahustunud), näeme, et lahus on elektrolüütiline, see tähendab, et see juhib elektrivoolu, kuna selles on ioone lahendus.

See tähendab, et vesi toimis reaktiivina, moodustades soolhappest ioone. See toimub vastavalt allpool toodud reaktsioonile:
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
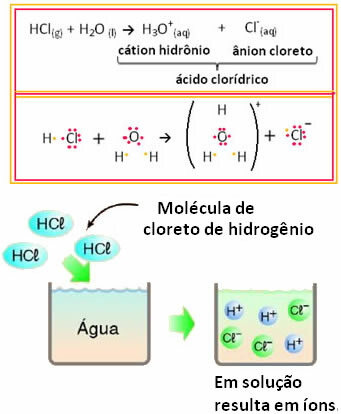
Pange tähele, et enne vesinikkloriidi vette laskmist ei olnud ioone. Kuid selle molekulid reageerisid veega ja moodustasid positiivseid H ioone3O+ (katioonid) ja negatiivsed Cl- (anioonid). Kuna kloor on rohkem elektronegatiivne kui vesinik, meelitab see elektronipaari lähedasest kovalentsest sidemest ja moodustab aniooni. Vesinikku seevastu tõmbab vees olev hapnik, mis on rohkem elektronegatiivne kui kloor; ning vesiniku ja hapniku vahel moodustub kovalentne side, mis põhjustab hüdrooniumkatiooni. Seda ioonide moodustumise nähtust nimetatakseionisatsioon.
Ülaltoodud selgituse põhjal saame ionisatsiooni määratleda järgmiselt:

Pange tähele, et ioone ei olnud varem olemas, sest kui need oleksid olemas, nagu ioonsete ühendite lahustumisel, oleks meil iooniline dissotsiatsioon ja mitte ionisatsioon.
Kõik veega kokkupuutuvad happed läbivad ionisatsiooni. Kuid mitte iga molekulaarne ühend ei läbi ioniseerimist.Näiteks suhkur (C12H22O11) on molekulaarne, kuid vette asetatuna ei moodustu ioone, see lihtsalt lahustub, tekitades mitteelektrolüütilise molekulaarse lahuse, mis ei juhi elektrit.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Ioniseerimine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/ionizacao.htm. Juurdepääs 28. juunil 2021.