määratleb ennast kui hübridiseerimine mittetäielike aatomorbitaalide liit. Orbitaal klassifitseeritakse mittetäielikuks, kui sellel on ainult üks elektron selle sees kahe asemel. Vaadake mittetäieliku ja täieliku orbiidi kujutist:

Pildil A on meil täielik orbitaal; pildil B mittetäielik orbiit.
Hübridiseerimine on loodusnähtus, mis esineb mõnede keemiliste elementide puhul, näiteks fosfor, väävel, süsinik jne. Süsiniku hübridisatsioon võimaldab selle elemendi aatomitel olla võimeline moodustama neli keemilist sidet, see tähendab, et süsinik loob pärast hübridisatsiooni nähtuse läbimist ainult neli sidet.
Kuid miks süsinik hübridiseerub ja loob neli sidet? Selle nähtuse mõistmiseks peame teadma selle elemendi elektroonilist levitamist:
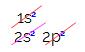
Süsiniku elektroonilises jaotuses näeme, et 1s alamtase on täielik (kahe elektroniga), 2s on täielik (kahe elektroniga) ja 2p alamtase on puudulik (p alamtase toetab kuut elektroni, kuid seal on ainult kaks). 2p elektronide tüüpilisel jaotamisel peame:
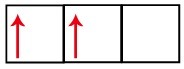
P alatasemel on kolm orbitaali - süsiniku korral on kaks neist mittetäielikud ja üks tühi. Seetõttu peaks see element teostama ainult kahte linki, kuna mittetäielike orbitaalide arv määrab alati linkide arvu.
Väliskeskkonnast energiat vastu võttes on süsinikus leiduvad elektronid siiski põnevil. Seega liigub üks alatasandil 2 asuvatest elektronidest alataseme p orbiidile, mis oli tühi:
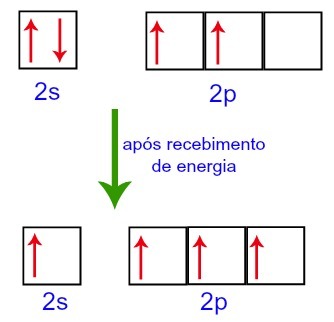
Süsinik Orbitaalid enne ja pärast väliskeskkonnast energia saamist
Seega on süsinikul teisel tasemel neli mittetäielikku orbitaali. Seejärel ühendab 2s alataseme orbitaal kolme p orbitaali, mis konfigureerib nähtuse hübridiseerimine.
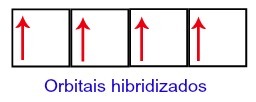
Süsiniku orbitaalid pärast hübridiseerumist
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm
