Nioobium (Nb) on perioodilise tabeli 5. rühma kuuluv aatomnumbri 41 keemiline element.
See on looduslikult kättesaadav tahke olekus siirdemetall, mille avastas 1801. aastal Briti keemik Charles Hatchett.
Nioobiumi sisaldavad mineraalid on maailmas haruldased, kuid rohkesti Brasiilias, riigis, kus on selle metalli suurim varu.
Tänu oma omadustele, kõrgele juhtivusele ja korrosioonikindlusele on sellel elemendil palju rakendusi, alates terasetootmisest kuni rakettide tootmiseni.
Järgmisena tutvustame seda keemilist elementi ja omadusi, mis muudavad selle nii oluliseks.

Mis on nioobium?
Nioobium on tulekindel metall, see tähendab, et see on väga vastupidav kuumusele ja kulumisele.
Selle klassi metallid on: nioobium, volfram, molübdeen, tantaal ja reenium, kusjuures nioobium on kõige kergem.
Nioobiumi leidub looduses mineraalides, mis on tavaliselt seotud teiste elementidega, peamiselt tantaaliga, kuna neil kahel on väga sarnased füüsikalis-keemilised omadused.
See keemiline element liigitatakse perioodilisustabelis üleminekumetalliks. See on särav, madala kõvadusega, vähese vastupidavusega elektrivoolu läbipääsule ja vastupidav korrosioonile.
Nioobiumi füüsikalised omadused
| füüsiline seisund | toatemperatuuril tahke |
|---|---|
| värv ja välimus | metallhall |
| Tihedus | 8,570 g / cm3 |
| Sulandumispunkt | 2468 ° C |
| Keemispunkt | 4742 ° C |
| Kristalliline struktuur | Kehakeskne kuup - CCC |
soojusjuhtivus |
54,2 W m-1 K-1 |
Nioobiumi keemilised omadused
| Klassifikatsioon | siirdemetall |
|---|---|
| aatomnumber | 41 |
| Blokeeri | d |
| Grupp | 5 |
| Ajakursus | 5 |
| aatommass | 92,90638 u |
| aatomikiir | 1,429 Å |
| tavalised ioonid | Nb5+ ja Nb3+ |
| elektronegatiivsus | 1.6 Pauling |
Selle metalli kasutamise peamine eelis on see, et seda elementi saab ainult grammides muuta tonni rauda, muutes metalli kergemaks, korrosioonikindlaks ja muuks tõhus.
Kust on leitud nioobiumi?
Võrreldes teiste looduses leiduvate ainetega on nioobiumi kontsentratsioon madal, osades 24 miljoni kohta.
Seda metalli leidub järgmistes riikides: Brasiilias, Kanadas, Austraalias, Egiptuses, Kongo Demokraatlikus Vabariigis, Gröönimaal, Venemaal, Soomes, Gabonis ja Tansaanias.
Nioobium Brasiilias
1950. aastatel avastas Brasiilias Brasiilia geoloog Djalma Guimarães suurima selle metalli sisaldava pürokloorimaagi lademe.
Suur hulk nioobiumi sisaldavaid maake asub Brasiilias, mis on maailma suurim tootja, kelle käes on üle 90% metalli varudest.
Uuritud reservid asuvad Minas Gerais, Amazonas, Goiás ja Rondônia osariikides.
nioobiumi maagid
Nioobiumi leidub looduses alati seotud teiste keemiliste elementidega. Looduses on juba teada üle 90 mineraaliliigi, mis sisaldavad nioobiumi ja tantaali.
Alljärgnevas tabelis näeme mõnda nioobiumi sisaldavat maaki, peamisi omadusi ja igas materjalis saadaolevat nioobiumi sisaldust.
| kolumbiit tantaliit | |
|---|---|
 | |
| Koostis: | (Fe, Mn) (Nb, Ta)2O6 |
| Nioobiumi sisaldus (maksimaalselt): | 76% Nb-st2O5 |
| Funktsioonid: |
|
| Püroklorit | |
|---|---|
 | |
| Kompositsioon: | (Kell2, Siin)2(Nb, Ti) (O, F)7 |
| Nioobiumi sisaldus (maksimaalselt): | 71% Nb-st2O5 |
| Funktsioonid: |
|
| Loparite | |
|---|---|
 | |
| Koostis: | (C, Na, C)2(Ti, Nb)2O6 |
| Nioobiumi sisaldus (maksimaalselt): | 20% Nb-st2O5 |
| Funktsioonid: |
|
nioobiumi uurimine
Nioobiumimaagid toimuvad muundamises kuni turustatavate toodete moodustumiseni.
Protsessi etapid võib kokku võtta järgmiselt:
- Kaevandamine
- Nioobiumi kontsentratsioon
- Nioobiumi rafineerimine
- Nioobiumi tooted
Kaevandamine toimub seal, kus on maagivarusid, mis kaevandatakse lõhkeainetega ja transporditakse vööde abil sinna, kus toimub kontsentreerimisetapp.
Kontsentratsioon toimub maagi lagunemisel, jahvatamine muudab maagi kristallid palju peenemaks ja kasutades magnetiline eraldamine rauafraktsioonid eemaldatakse maagist.
Nioobiumi rafineerimisel toimub väävli, vee, fosfori ja plii eemaldamine.
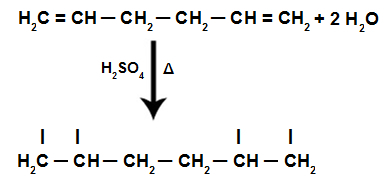
Üks nioobiumi sisaldavatest toodetest on raud-nioobiumisulam, mida toodetakse järgmise võrrandi kohaselt:
Seda protsessi nimetatakse aluminotermiaks, kus maagikontsentraat segatakse reaktorites rauajäägi või raudoksiidiga.
Metalloksiidid reageerivad alumiiniumiga kõrgel temperatuuril, tekitades huvipakkuva toote.
Kõige enam turustatakse nioobiumi tooteid:
- Nioobiumi kontsentraadid: alus, mis sisaldab 58% Nb2O5.
- Raud-nioobiumisulam: sisaldab 65% nioobiumi.
- Kõrge puhtusastmega oksiid: kasutatakse spetsiaalsete materjalide tootmiseks.
Milleks on nioobium?
Nioobiumi omadused muudavad selle elemendi üha enam soovitavaks ja koos arvukate rakendustega.
Alates selle avastamisest 1905. aastal hakati uurima nioobiumi rakendusi, kui Saksa keemik Werner von Bolton tootis elemendi puhtal kujul.
50-ndad tähistasid suurt nioobiumirakenduste otsingut, kuna seni ei toodetud seda massiliselt.
Sel perioodil tekitas külm sõda huvi selle metalli vastu, mida kasutatakse kosmosesõidukite komponentides.
Allpool on loetelu viisidest, kuidas nioobiumi kasutatakse.
Metallisulamid

Nioobiumi lisamine sulamile suurendab selle kõvenemist ehk võimet tahkestuda kuumuse käes ja seejärel jahtuda. Seega saab nioobiumi sisaldavat materjali spetsiifiliselt kuumtöötleda.
Nioobiumi afiinsus süsiniku ja lämmastikuga soodustab sulami mehaanilisi omadusi, suurendades näiteks mehaanilist tugevust ja vastupidavust abrasiivsele kulumisele.
Need mõjud on kasulikud, kuna võivad laiendada sulami tööstuslikke rakendusi.
Näiteks teras on metallisulam, mis moodustub rauast ja süsinikust. Nioobiumi lisamisel sellele sulamile võib olla eeliseid:
- Autotööstus: auto tootmine kergem ja kokkupõrkekindlam.
- Ehitus: parandab terase keevitatavust ja annab vormitavuse.
- Transporditorustik: Võimaldab õhemate seinte ja suurema läbimõõduga konstruktsioone, ilma et see mõjutaks ohutust.
super sulamid

Supersulam on metallisulam, millel on kõrge vastupidavus kõrgetele temperatuuridele ja mehaaniline tugevus. Nioobiumi sisaldavad sulamid muudavad selle materjali kasulikuks lennukiturbiinide tootmisel või energia tootmisel.
Kõrgel temperatuuril töötamise eelis paneb ülisulamid kompenseerima suure jõudlusega reaktiivmootorid.
ülijuhtivad magnetid

Nioobiumi ülijuhtivus põhjustab nioobiumi-germaaniumi, nioobiumskandiumi ja nioobium-titaani ühendite kasutamist:
- MRI-aparaatide skanner.
- Osakeste kiirendid, näiteks suur hadroni kollider.
- Elektromagnetkiirguse tuvastamine ja kosmilise kiirguse uurimine nioobiumnitritit sisaldavate materjalide abil.
Oksiidid
Muud nioobiumi kasutusalad on oksiidid, peamiselt Nb2O5. Peamised kasutusalad on:
- optilised läätsed
- Keraamilised kondensaatorid
- pH-andurid
- mootori osad
- Ehted
Nioobiumi ajalugu ja avastamine
1734. aastal viidi mõned John Winthropi isiklikusse kollektsiooni kuuluvad maagid Ameerikast Inglismaale ja need esemed olid osa Londoni Briti muuseumi kogust.
Kuningliku seltsiga liitumisel keskendus Briti keemik Charles Hatchett muuseumis saadaolevate maagide koostise uurimisele. Nii eraldas ta 1801. aastal oksiidi kujul keemilise elemendi ja nimetas selle kolumbiumiks ja maagiks, millest see ekstraheeriti.
1802. aastal teatas Rootsi keemik Anders Gustaf Ekeberg uue keemilise elemendi avastamisest ja nimetas selle tantaaliks, viidates Kreeka mütoloogias Zeusi pojale.
1809. aastal analüüsis inglise keemik ja füüsik William Hyde Wollaston neid kahte elementi ja märkis, et neil on väga sarnased omadused.
Selle asjaolu tõttu peeti aastatel 1809–1846 kolumbiumit ja tantaali samaks elemendiks.
Hiljem märkis kolumbiidimaaki uuriv saksa mineraloog ja keemik Heinrich Rose, et seal on ka tantaali.
Rose leidis veel ühe tantaaliga sarnase elemendi olemasolu ja nimetas seda Niobiuseks, viidates Kreeka mütoloogiast pärit Tantalose tütrele Niobele.
1864. aastal õnnestus rootslasel Christian Bromstrandil vesiniku atmosfääris kuumutatud kloriidi proovist eraldada nioobium.
1950. aastal kinnitas puhta ja rakendusliku keemia liit (IUPAC) ametlikuks nimeks nioobium, mitte kolumbium, kuna need olid sama keemiline element.
Nioobiumi kokkuvõte
Keemiline element: nioobium | |||
|---|---|---|---|
| Sümbol | Nb | Avastaja | Charles Hatchett |
| aatomnumber | 41 | aatommass | 92 906 u |
| Grupp | 5 | Ajakursus | 5 |
| Klassifikatsioon | siirdemetall | Eletrooniline jaotus | [Kr] 4d35s2 |
| Funktsioonid |
|
||
| Põhimaagid |
|
||
| Peamised tooted |
|
||
| rakendused |
|
||
| Esinemine | Maailmas |
|
|
| Brasiilias |
|
Vaenlase harjutused ja sisseastumiseksamid
1. (Enem / 2018) Kreeka mütoloogias oli Niobia Tantaluse, kahe kannatuse poolest tuntud tegelase tütar. Keemilisel elemendil, mille aatomnumber (Z) on 41, on keemilised ja füüsikalised omadused nii sarnased aatomnumbriga 73, et need aeti segi.
Seetõttu anti Kreeka mütoloogias nende kahe tegelase auks neile elementidele nioobiumi (Z = 41) ja tantaali (Z = 73) nimed. Need kaks keemilist elementi on metallurgias, metalli tootmisel omandanud suure majandusliku tähtsuse ülijuhtides ja muudes tipptasemel tööstuslikes rakendustes just keemiliste ja füüsikaliste omaduste tõttu ühine mõlemale.
KEAN, S. Kaduv lusikas: ja muud tõelised lood hullumeelsusest, armastusest ja keemiliste elementide surmast. Rio de Janeiro: Zahar, 2011 (kohandatud).
Nende elementide majanduslik ja tehnoloogiline tähtsus tuleneb nende keemiliste ja füüsikaliste omaduste sarnasusest
a) on alamtasemel f elektronid.
b) olles sisemise ülemineku elemendid.
c) kuuluvad perioodilisustabeli samasse rühma.
d) nende välimised elektronid on vastavalt tasemel 4 ja 5.
e) asuvad vastavalt leelismuld- ja leeliseliste perekonnas.
Õige alternatiiv: c) kuuluvad perioodilisustabeli samasse rühma.
Perioodiline tabel on jaotatud 18 rühma (perekonda), kus iga rühm koondab sarnaste omadustega keemilisi elemente.
Need sarnasused tekivad seetõttu, et rühma elementidel on valentskoores sama arv elektrone.
Tehes elektroonilise jaotuse ja lisades elektronid kõige energilisemast alatasemest äärmise alamtasemeni, leiame rühma, kuhu need kaks elementi kuuluvad.
| Nioobium | |
|
Levitamine elektroonika |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p65s2 4d3 |
|
summa elektronid |
energilisem + rohkem väline 4d3 + 5 s2 = 5 elektroni |
| Grupp | 5 |
| Tantaal | |
|
Levitamine elektroonika |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f145d3 |
|
summa elektronid |
energilisem + rohkem väline 5d3 + 6 s2 = 5 elektroni |
| Grupp | 5 |
Elementideks nioobium ja tantaal:
- Nad kuuluvad perioodilisustabeli samasse rühma.
- Nende äärmised elektronid on vastavalt 5. ja 6. tasemel ning asuvad seega 5. ja 6. perioodil.
- Neil on elektronid alamtasemel d ja seetõttu on nad väljaspool siirdeelemente.
2. (IFPE / 2018) Brasiilia on maailma suurim nioobiumitootja, moodustades üle 90% selle metalli reservist. Nioobiumi, sümbolit Nb, kasutatakse eriteraste tootmisel ja see on üks korrosioonile ja äärmuslikele temperatuuridele vastupidavamaid metalle. Nb ühend2O5 see on peaaegu kõigi sulamite ja nioobiumiühendite eelkäija. Märkige alternatiiv vajaliku massiga Nb2O5 465 grammi nioobiumi saamiseks. Arvestades: Nb = 93 g / mol ja O = 16 g / mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Õige alternatiiv: e) 665 g
Nioobiumi eelühend on Nb oksiid2O5 ja sulamites kasutatav nioobium on elementaarsel kujul Nb.
Seetõttu on meil järgmine stöhhiomeetriline seos:
1 mool Nb2O5 tekitab 2 mooli Nb, kuna nioobiumoksiid moodustub selle metalli 2 aatomist.
1. samm: arvutage toodetud nioobiumi moolide arv, mis vastab 465 g-le.
Kui arvutuse järgi nägime, et nioobiumi mass vastab 5 molile, siis Nb moolide arv2O5 kasutatud on pool sellest väärtusest, sest:
2. samm: arvutage nioobiumoksiidi molaarmass.
3. samm: arvutage nioobiumoksiidi mass, mis vastab 2,5 molile.
3. (UECE / 2015) Brasiilial on 98% kogu maailma nioobiumi varudest, millel on arvukalt tööstuslikke rakendusi, näiteks juveeltoodete tootmisel, hüperallergilised implantaadid, elektrokeraamika, ülijuhtivad magnetid, magnetresonantsmasinad, metallisulamid, spetsiaalsed mündid ja terasest. Nioobiumi puhul vaadake allolevad väited üle ja märkige ainus tõeline alternatiiv.
a) Selle diferentsiaalelektron asub eelviimases kestas.
b) see on tüüpiline element.
c) Selle elektronegatiivsus on madalam kui vanaadiumil.
d) see kuulub perioodilisustabeli neljandasse perioodi.
Õige alternatiiv: a) Selle diferentsiaalelektron asub eelviimases kestas.
Nioobiumi elektroonilise levitamise teostamisel on võimalik näha, et selle diferentsiaalelektron asub eelviimases kestas.
Kuna sellel on alamtasemel d diferentsiaalelektron, on see väline üleminekuelement.
Kuna selle äärmine tase on viiendas kihis, asub nioobium tabeli viiendal perioodil.
Elektronegatiivsus on omadus, mis on seotud elemendi elektronide ligimeelitamise võimalusega ja see varieerub vastavalt aatomiraadius: mida väiksem on aatomi raadius, seda suurem on elektronide ligitõmbavus ja seetõttu seda suurem elektronegatiivsus.
Elektroonegatiivsuse väärtustega tabelit uurides on võimalik näha, et nioobiumil ja vanaadiumil on väärtus 1,6 Paulingi lähedal.
4. (UEA / 2014) Nioobiumi looduslik isotoop on 93Nb. Neutronite arv selles isotoopis on
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Õige alternatiiv: b) 52.
Isotoopid on erineva massinumbriga keemilise elemendi aatomid.
Aatomimass vastab elemendi prootonite ja neutronite summale.
Prootonite arv tähistab keemilise elemendi aatomnumbrit ja isotoopide puhul see ei muutu.
Seega toimub isotoopide massiline varieeruvus neutronite erineva arvu tõttu.
Kui nioobiumi aatomnumber on 41, siis arvutatakse neutronite arv:
5. (IFMG / 2015) Keemiline element nioobium Nb on nimetatud Kreeka jumalanna Niobe järgi. Brasiilia on maailma suurim metalli tootja, kelle toodang moodustab 75%. Tänu oma sulamite termilisele stabiilsusele kasutatakse nioobiumi spetsiaalsete kõrgtugevate terasest sulamite tootmiseks mootoritele, tõukejõuseadmetele ja mitmesugustele ülijuhtivatele materjalidele. Jälgides nioobiumi positsiooni perioodilisustabelis, on õige öelda, et:
a) teie kõige energilisem alamtase on alamtase d.
b) on leelismetallide perekonda kuuluv element.
c) moodustab ioonseid ühendeid teiste metallidega.
d) selle katioonide aatomi raadius on suurem kui puhtal elemendil.
Õige alternatiiv: a) teie kõige energilisem alamtase on alamtase d.
Perioodilisustabelit vaadates näeme, et nioobiumi iseloomustatakse välise siirdeelemendina, mis kuulub perioodilisustabeli 5. rühma, kuna selle kõige energilisem alamtase on d.
Selle teabe võime saada ka elektrooniliselt levitades.
Kuna tegemist on metalliga, loob see element metallist ühendusi teiste metallidega, nagu sulamis raud-nioobium või ka kovalentsed sidemed, jagades elektrone, nagu nioobiumoksiidil Nb2O5.
6. (UFSC / 2003) Nioobiumi avastas 1801. aastal inglise keemik Charles Hatchett. Brasiilias on umbes 93% maailma nioobiumikontsentraadi toodangust. Suurimad maardlad asuvad Minas Gerais, Goiás ja Amazonas osariikides. Metalli kasutatakse peamiselt raua-nioobiumisulamite ja muude keerukamate sulamite valmistamiseks, mida on kasutatud reaktiivmootorite, rakettide ja kosmosesõidukite ehitamisel. Selle oksiide kasutatakse prillide, fotokaamerate ja muude optiliste seadmete valgusläätsede valmistamiseks. Antud (Z = 41). Märkige nioobiumi kohta ÕIGE ettepanek (ud).
(01) Nioobium võtab 3 elektroni kaotamisel krüptooni konfiguratsiooni.
(02) Nioobium võib moodustada M-tüüpi metalloksiide2O5 aastal2O3.
(04) Nioobiumi keemiline sümbol on Ni.
(08) Nioobium on siirdemetall.
(16) Raud-nioobiumisulam on tahke lahuse näide.
Õiged alternatiivid: 02 + 08 + 16 = 26.
(01) VALE.
| Elemendid | Eletrooniline jaotus |
| 36Kr | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
|
41Nb 41Nb3+ |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d3 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4p6 4d2 |
(02) ÕIGE
Võttes arvesse nioobiumi oksüdatsiooninumbreid 3+ ja 5+, võib see moodustada ühendeid:
| Oksüdatsiooninumber 5+ | Oksüdatsiooninumber 3+ |
| Nb2O5 | Nb2O3 |
(04) VALE
Ni on nikli elemendi sümbol. Nioobiumi sümbol on Nb.
(08) ÕIGE
Nioobium on perioodilise tabeli 5. rühma kuuluv väline siirdemetall.
(16) ÕIGE
Tahke lahus vastab kahe või enama sama faasi komponendi segule, mis on tahke ja metallide seas tavaline.
7. (UERJ / 2013) Nioobium on metall, mida leidub looduslikes ladestustes, peamiselt oksiidide kujul.
Omistamisnumbriga +5 nioobiumi sisaldavas maardlas vastab selle metalli valdava oksiidi valem järgmisele:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
Õige alternatiiv: d) Nb2O5
Hapnik loob kaks sidet ja sellel on kindel oksüdatsiooninumber, mis on 2-.
Seetõttu peab nioobiumoksiidi moodustamiseks hapnik seonduma selle metalli 2 aatomiga.
Nioobiumil on erinevad oksüdatsiooniastmed. Oksüdatsiooninumbriga 3+ seondub see 3 oksügeeniga ja Nox 5+ -ga moodustab ühendi: Nb2O5 kus 2 nioobiumi aatomit seotakse 5 hapnikuaatomiga.

8. ja 10. küsimusele vastamiseks lugege teksti.
Nioobium on suure tehnoloogilise tähtsusega metall ja selle peamised maailmavarud asuvad Aafrikas
Brasiilia pürokloorimaagi kujul, mis koosneb Nb-st2O5. Selle ekstraheeriva metallurgia ühes protsessis kasutatakse alumiiniumtermiat Feoksiidi juuresolekul2O3, mille tulemuseks on kõrvalsaadusena nioobiumi ning raua ja alumiiniumoksiidi sulam. Selle protsessi reaktsioon on esitatud võrrandis:
Looduses ilmub nioobium stabiilse isotoobi nioobium-93 kujul, kuid on teada mitu ebastabiilset sünteetilist isotoopi, mis lagunevad kiirguse mõjul. Üks neist on nioobium-95, mis laguneb elemendiks molübdeen-95.
(Systems.dnpm.gov.br; Tehnoloogia Metallist. Mater. Kaevur., São Paulo, v. 6, nr. 4, lk. 185-191, aprill-juuni. 2010 ja G. Audi jt / Tuumafüüsika A 729 (2003) 3–128. Kohandatud)
8. (FGV / 2019) Alumiinotermia reaktsioonis nioobiumi ja raua sulami saamiseks on tasakaalustatud võrrandis esitatud stöhhiomeetriat arvestades protsessis osalevate elektronide koguarv
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Õige alternatiiv: e) 36.
Redoksreaktsioon toimub elektronide kadumise ja võimendumisega.
Kui element vähendab, saab see elektrone ja oksüdeerudes kaotab see elektronid.
Kui element taandub, on see oksüdeeriv aine, samas kui element oksüdeerub, on see redutseerija.
Sel viisil on ühe elemendi poolt kaotatud ja teisele loovutatud elektronide arv võrdne.
| Element | NOX | Reaktsioon | elektronid | |
| Nioobium |
+5 3Nb2O5 |
0 6Nb |
Reduktsioon | 3.2.5 = 30 ja- kasu |
| Raud |
+3 Usk2O3 |
0 2Fe |
Reduktsioon | 2,3 = 6 ja- kasu |
| Alumiinium |
0 12Al |
+3 6Al2O3 |
Oksüdeerumine | 6.2.3 = 36 ja- kadunud |
Alumiiniumoksiidtoote alumiiniumlaeng on 3+, see tähendab, et iga alumiinium on kaotanud 3 elektroni.
Kuid toodetes on meil 12 alumiinium aatomit, mis teeb protsessis osalevate elektronide koguarvuks:
12. 3 = 36 elektroni.
9. (FGV / 2019) Alumiinotermiaoperatsioonis stöhhiomeetriliste koguste Nb-i ja rauasulami tootmiseks2O5 ja Fe2O3 ja üleliigse metallilise alumiiniumi kasutamisel tekkis 6,12 tonni Al-i.2O3. Nioobiumi ja raua hinnanguline kogus selles moolis on moolides
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Õige alternatiiv: d) 8 × 104.
1. samm: arvutage Al molaarmass2O3
2. samm: arvutage Al-i moolide arv2O3
3. samm: tehke stöhhiomeetrilised seosed.
Keemilises võrrandis näeme, et on olemas seos: 6 mooli nioobiumi, 6 mooli alumiiniumi ja 2 mooli rauda.
Moodustatud moolide arvu suhte järgi on meil:
Nioobiumi ja raua kogus moolides on:

Nioobium-95 radioisotoopide lagunemisprotsessis on selle proovi aktiivsuse lagunemise aeg 25 MBq-ni ja eraldatud liigi nimi
a) 140 päeva ja neutronid.
b) 140 päeva ja prootoneid.
c) 120 päeva ja prootonid.
d) 120 päeva ja osakesed ß–.
e) 140 päeva ja osakesed ß–.
Õige alternatiiv: e) 140 päeva ja osakesed ß–.
Poolväärtusaeg on aeg, mis kulub radioaktiivse proovi aktiivsuse poolitamiseks.
Graafikul näeme, et radioaktiivne aktiivsus algab 400 MBq-st, seega poolväärtusaeg on aeg, mis kulus tegevuse lagunemiseks 200 MBq-ni, mis on pool esialgsest.
Analüüsime graafikul, et see aeg oli 35 päeva.
Selleks, et aktiivsus jälle poole võrra langeks, möödus veel 35 päeva ja aktiivsus tõusis 200 MBq-lt 100 MBq-ni, kui möödus veel 35 päeva, see tähendab 400 päevalt 100 MBq-le 70 päeva.
Proovi lagunemiseks kuni 25 MBq oli vaja 4 poolväärtusaega.
Mis vastab:
4 x 35 päeva = 140 päeva
Radioaktiivse lagunemise korral võivad emissioonid olla alfa-, beeta- või gammakiirgus.
Gammakiirgus on elektromagnetlaine.
Alfa-emissioonil on positiivne laeng ja see vähendab lagunenud elemendi 4 massiühikut ja 2 ühikut aatomnumbris, muutes selle teiseks elemendiks.
Beetaemissioon on kiire elektron, mis suurendab lagunenud elemendi aatomnumbrit ühe ühiku võrra, muutes selle teiseks elemendiks.
Nioobium-95 ja molübdeen-95 on sama massiga, mistõttu beetaemissioon tekkis, kuna: