O aatomikiir elementide element on perioodiline omadus, mis määrab aatomi raadiuse, mis varieerub sõltuvalt elemendi asukohast perioodilisustabelis.
Seega võivad need suureneda ja väheneda kui aatomnumber (Z) elemendist, mis vastab aatomite tuumas olevate prootonite arvule.
Kokkuvõttes vastab aatomi raadius kahele naaber aatomi tuumade vahelisele kaugusele, väljendatuna järgmiselt:
r = d / 2
kust:
r = raadius
d = tuumadevaheline kaugus
Üldiselt mõõdetakse aatomi raadius pikomeetrites (pm), arvesti alamkordaja (1 pikomeeter = 10-12 m.). Pange tähele, et kui referents pole mitte aatom, vaid ioon, on leitud raadius ioonraadius.
Aatomiraadiuse variatsioon
Perioodilisustabelis on aatomiraadiuse kasvu näha järgmisel joonisel:
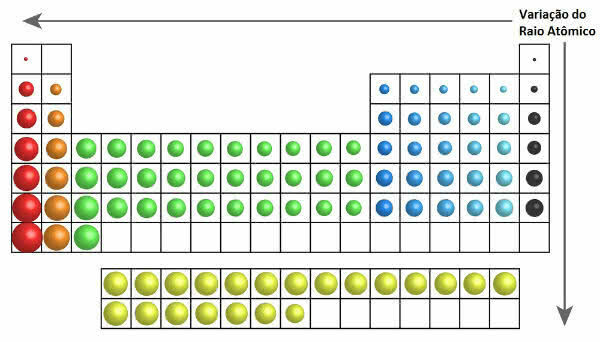 Aatomiraadiuse varieerumine perioodilisustabelis
Aatomiraadiuse varieerumine perioodilisustabelis
Seega vertikaalselt (perekonnad või rühmad) suureneb aatomi raadius ülevalt alla. Horisontaalselt (punktid) kasvavad nad paremalt vasakule.
Vaadake pöördvariatsiooni Elektrooniline ühine huvi ja elektronegatiivsus.
Ionisatsioonienergia
THE ionisatsioonienergia (või potentsiaal) see on ka perioodiline omadus, mis määrab elektroni nihutamiseks vajaliku energia, mida väljendatakse elektronvoltides (eV).
Loe ka: Perioodilised omadused.
Kontrollige sisseastumiseksami küsimusi kommenteeritud resolutsiooniga: Harjutused perioodilisustabelis.