Nimed saanud elemendid leelismuldmetallid on need, mis kuuluvad perioodilisustabeli perekonda 2 või IIA. Sellesse rühma kuuluvad järgmised keemilised elemendid: Ole (berüllium), Mg (magneesium), Ca (kaltsium), Sr (strontsium), Ba (baarium) ja raadium (Ra).

Neil on valentskoores kaks elektroni ja nende üldist jaotust tähistab ns2, kus ei tähistab viimase taseme numbrit. Selle omaduse tõttu kipuvad nad kaotama need kaks elektroni, põhjustades 2+ laengkatiooni.
Mõiste „maa“ viitab „olemasolevale maa peal“, kuna just neid elemente leidub peamiselt mineraalides. Näiteks kaltsium kaltsiumfosfaatühendi (Ca3(TOLM4)2), leidub maakoores ja on toorainena fosfori tootmiseks. Seda leidub ka loomade luudes nii palju, et nende kaltsineerimisel saadakse nn “kondijahu”, mis sisaldab kaltsiumfosfaati.
Leelismuldmetallide seas on kõige rohkem silma paistnud Kaltsium see on Magneesium.
- Kaltsium
Kaltsiumiioon (Ca2+) on umbes 90% meie luudest ja hammastest; ja loomadel esineb seda ka nende kestades. Selle ülesanne on tugevdada luustruktuuri ja olla lihasrelaksant. Kaltsiumi puudumine kehas võib põhjustada lihaskrampe, teetanust ja osteoporoosi. Seetõttu on oluline seda süüa kaltsiumirikaste toitude, näiteks piima ja selle derivaatide (või, juust jne), liha ja köögiviljade kaudu.
Teisalt võib liiga palju kaltsiumi põhjustada lihaste lõdvestumist, neerukive ja luuvalu.
Lisaks eelmainitud toitudele leidub kaltsiumi endiselt paljudes looduse piirkondades, eriti mineraalides nagu kaltsiit (CaCO3) või kaltsiumkarbonaati, mis on lubjakivi ja marmori koostisosa, ning marmorit kasutatakse valamute, kujude, põrandate ja treppide valmistamiseks. Kaltsiumkarbonaat on koobastes ka stalaktiitide ja stalagmiitide ehitaja. Kaltsiumi leidub ka looduslikus kipsis (CaSO4. 2 tundi2O), mida nimetatakse kipsiks. Seda soola saab dehüdreerida, põhjustades CaSO4 veevaba, mis on kooli kriit.
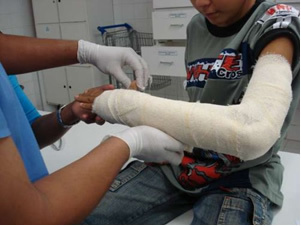
Tööstuses toodetakse värsket lubja (CaO), kustutatud lubi, mida nimetatakse ka hüdraatunud lubjaks või kustutatud lubjaks, mis on tegelikult kaltsiumhüdroksiid (Ca (OH)2), mida kasutatakse lubivärvides ja mördi valmistamisel. Kipsi õrn kuumutamine võimaldab saada ehituses kasutatava hemihüdreeritud kaltsiumsulfaadi, milleks on kips. kodanikuühiskond, luu luumurdude kaitsmiseks hambaravis ja meditsiinis kasutatavate vormide tootmisel, näiteks allpool näidatud käsivarre luumurdude kaitsmiseks.
- Magneesium
ioon magneesium sel on ka suur bioloogiline tähtsus, kuna seda leidub 70% meie luudes, soosides ensüümide, lihaste ja motoorse koordinatsiooni toimet. Selle puudumine kehas võib põhjustada desorientatsiooni, hüpertensiooni, värinaid ja nõrka pulssi. Seetõttu peaksime sööma järgmisi toitu, mis seda elementi sisaldavad: pähklid, teraviljad ja rohelised köögiviljad. Samuti võib liigne magneesium kehas põhjustada unisust.
Magneesiumi leidub ka merevees ja mineraalides. Seda kasutatakse metallisulamites, näiteks ohvermetallides (mis oksüdeeruvad terase asemel, vältides selle korrosiooni), magneesiumratastes ja ilutulestikes (pakkudes hõbedat ja valget värvi). Väga oluline magneesiumiühend on magneesiumhüdroksiid (Mg (OH)2), mis vees hajutatult kontsentratsiooniga umbes 7% annab teadaoleva suspensiooni rahva seas magneesiumpiim, mis toimib antatsiidina, võideldes mao happesuse (kõrvetised) ja lahtistav.

Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm

