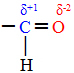Ionisatsioonienergia on a perioodiline omadus, mis näitab energiat, mis on vajalik elektroni ülekandmiseks põhiolekus olevast aatomist.
Aatom on põhiolukorras, kui tema prootonite arv on võrdne elektronide arvuga.
Elektroni (te) ülekandumist aatomist nimetatakse ionisatsiooniks. Seetõttu nimetatakse selle toimumiseks vajalikku energiat ionisatsioonienergiaks, tuntud ka kui Ionisatsioonipotentsiaal.
Esimene eemaldatud elektron on see, mis asub aatomi tuumast kõige kaugemal. Kaugus hõlbustab ülekannet, sest mida kaugemal tuumast, mis on positiivne, seda vähem energiat kulub, et elektron sealt välja saaks.
Järgmine (d) elektron (id) vajavad rohkem energiat. Seega võime öelda, et 1. ionisatsioonienergia (E.I) on väiksem kui 2.ionisatsioonienergia. Teine on omakorda väiksem kui kolmas ionisatsioonienergia ja nii edasi:
1. E.I
Seda seetõttu, et aatomikiir selle suurus suureneb, kui iga elektron eemaldatakse aatomist. Selle tulemusel lähevad elektronid aatomituumale järjest lähemale.
Kontrollige järjestikuseid hapnikuionisatsiooni energiaid:
O -> O+: 1313,9 kJ mol-1
O+1 -> O+2: 3388,2 kJ mol-1
O+2 -> O+3: 5300,3 kJ mol-1
O+3 -> O+4: 7469,1 kJ mol-1
O+4 -> O+5: 10989,3 kJ mol-1
Kui aatomil on pärast elektroni eemaldamist prootoneid rohkem kui elektrone, muutub see aatom katiooniks.
Loe ka:
- Ioon, katioon ja anioon
- ionisatsioon
Nii juhtub näiteks siis, kui eemaldame vesinikust elektroni. Vesinik koosneb 1 prootonist ja 1 elektronist.
Pärast elektroni eemaldamist jääb vesiniku tuumas ainult üks prooton. See tähendab, et vesinik ioniseeriti ja sellest sai katioon, mis on sama mis öelda, et sellest sai positiivne ioon.
Ionisatsioonienergia perioodilisustabelis
Aatomiraadius suureneb perioodilisustabeli paremalt vasakule ja ülevalt alla.
Seda teades suureneb ionisatsioonienergia vastupidises suunas, see tähendab, et see on suurem vasakult paremale ja alt üles.

Vähem ioniseerivat energiat vajavate elementide hulka kuuluvad leelismetallidnäiteks kaalium.
Väärgaasid on üldiselt need, mis vajavad suuremat ionisatsiooni energiat, näiteks argoon.
Eemaldamisenergia x ioniseerimisenergia
Eemaldamisenergia on väga sarnane ionisatsioonienergiaga. Nende kahe erinevus seisneb selles, et eemaldamise energiat saab seostada fotoelektrilised efektid.
Fotoelektrilised efektid on elektronid, mida tavaliselt kiirgavad valguse käes olevad metallmaterjalid.
Selle tulemusena ei järgi elektronide eemaldamine eemaldamisenergias järjestust, nagu juhtub ionisatsioonienergiaga.
Ionisatsioonienergias on esimesed eemaldatud elektronid tuumast kõige kaugemal.
Elektrooniline ühisus
THE elektrooniline afiinsus see mõjutab ka aatomite käitumist, kuid vastupidi.
See on perioodiline omadus, mis näitab energiat, mis vabaneb, kui aatom saab elektroni. Teiselt poolt on ionisatsioonienergia energia, mis on vajalik elektronide eemaldamiseks aatomist.
Loe ka elektropositiivsus ja elektronegatiivsus.
Harjutused
1. (PUCRS) Arvestades elementide positsiooni perioodilisustabelis, on õige öelda, et allpool loetletud elementide hulgas on kõige väiksema raadiusega ja kõrgeima ionisatsioonienergiaga element
a) alumiinium
b) argoon
c) fosfor
d) naatrium
e) rubiidium
b) argoon
2. (UEL) Perioodilises klassifikatsioonis KASVAB keemiliste elementide ionisatsioonienergia
a) otsast keskpunkti, periooditi.
b) otsadest keskpunkti, perekondades.
c) paremalt vasakule, periooditi.
d) ülevalt alla, perekondades.
e) alt üles, perekondades.
e) alt üles, perekondades.
3. (Uece) Olgu järgnevad neutraalsed aatomid kujutatud hüpoteetiliste sümbolite X, Y, Z ja T ning nende vastavate elektrooniliste konfiguratsioonidega:
X → 1s2
Y → 1s2 2s2
Z → 1s2 2s2 2p6 3s2 3p6
T → 1s2 2s2 2p6 3s2 3p6 4s2
Suurima ionisatsioonienergiaga on:
jah
b) Z
c) T
d) X
d) X
4. (Ufes) Broomi esimene ionisatsioonienergia (Z = 35) on 1139,9 kJ / mol. Kontrollige alternatiivi, mis sisaldab vastavalt fluori (Z = 9) ja kloori (Z = 17) esimesi ionisatsioonienergiaid kJ / mol.
a) 930,0 ja 1008,4
b) 1008,4 ja 930,0
c) 1 251,1 ja 1 681,0
d) 1 681,0 ja 1 251,1
e) 1 251,0 ja 930,0
d) 1 681,0 ja 1 251,1
Kontrollige sisseastumiseksami küsimusi kommenteeritud resolutsiooniga: Harjutused perioodilisustabelis.