Orgaanilised reaktsioonid on reaktsioonid, mis toimuvad orgaaniliste ühendite vahel. Reaktsioone on mitut tüüpi, mis tekivad molekulide purustamisel, mis tekitavad uusi sidemeid.
Tööstuses laialdaselt kasutatavate ravimite ja kosmeetikatoodete, plasti, muu hulgas saab valmistada just nendest.
peamine orgaaniliste reaktsioonide tüübid nemad on:
- liitmisreaktsioon
- asendusreaktsioon
- eliminatsioonireaktsioon
- Oksüdatsioonireaktsioon
Liitmisreaktsioon
Liitumisreaktsioon toimub siis, kui orgaanilise molekuli sidemed purunevad ja sellele lisatakse reaktiiv.
See juhtub peamiselt ühendites, mille ahelad on avatud ja millel on küllastumata, nagu alkeenid () ja alküünid (
).
Lisamisreaktsioonide näited
Näide 1: hüdrogeenimine (vesiniku lisamine)
Alkeeni hüdrogeenimisel saadakse alkaan.
Näide 2: halogeenimine (halogeenide lisamine)
Alkeeni halogeenimisel tekib halogeniid.
Näide 3: niisutamine (vee lisamine)
Alkeeni hüdratsioonil tekib alkohol.
Loe ka: Orgaanilised ühendid
Asendusreaktsioon
Asendusreaktsioon toimub siis, kui on olemas sidumisatomid (või rühm), mis on asendatud teistega.
See juhtub peamiselt alkaanide, tsüklaanide ja aromaatsete ainete seas.
Näited asendusreaktsioonidest
Näide 1: halogeenimine (asendamine halogeeniga)
Alkaani halogeenimisel tekib halogeniid.
Näide 2: nitraat (asendamine nitroga)
Alkaani nitreerimine annab nitroühendi.
Näide 3: sulfoonimine (asendamine sulfoonikaga)
Alkaani sulfoonimisel tekib hape.
Loe ka: Orgaanilised funktsioonid
Likvideerimisreaktsioon
Eliminatsioonireaktsioon toimub siis, kui orgaanilisest molekulist eemaldatakse süsiniku ligand.
See reaktsioon on vastuolus liitumisreaktsiooniga.
Eliminatsioonireaktsioonide näited
Näide 1: vesiniku eliminatsioon (dehüdrogeenimine)
Alkaanist vesiniku eemaldamisel tekib alkeen.
Näide 2: halogeenide eemaldamine (de-halogeenimine)
Halogeenide elimineerimisel dihaliidist tekib alkeen.
Näide 3: halogeniidide eliminatsioon
Halogeniidi eemaldamine halogeniidist annab alkeeni.
Näide 4: vee kõrvaldamine (alkoholi dehüdratsioon)
Alkoholi vee eemaldamisel tekib alkeen.
Vaadake ka: esterdamine
Oksüdatsioonireaktsioon
Oksüdatsioonireaktsioon, mida nimetatakse ka redoksiks, toimub siis, kui toimub elektronide võimendus või kaotus.
Oksüdeerimisreaktsioonide näited
Näide 1: alkeenide energeetiline oksüdeerumine
Alkeeni energeetiline oksüdeerimine tekitab karboksüülhappeid.
Näide 2: esmane alkoholi oksüdeerumine
Primaarse alkoholi energeetiline oksüdeerimine tekitab karboksüülhapet ja vett.
Näide 3: sekundaarne alkoholi oksüdeerumine
Sekundaarse alkoholi oksüdeerimisel tekivad ketoon ja vesi.
Loe ka: Karboksüülhapped
Orgaaniliste reaktsioonide harjutused
küsimus 1
(Unifesp / 2002) Paljusid alkohole võib saada alkeenide happega katalüüsitud hüdratsiooni teel.
Selles liitumisreaktsioonis lisatakse vees sisalduv H süsinikule, milles on rohkem vesinikke, ja hüdroksüülrühm on seotud vähem hüdrogeenitud süsinikuga (Markovnikovi reegel).
Teades, et kahe alkeeni hüdreerimisel moodustunud alkoholid on vastavalt 2-metüül-2-pentanool ja 1-etüültsüklopentanool, siis mis on nende tekitanud vastavate alkeenide nimed?
a) 2-metüül-2-penteen ja 2-etüültsüklopenteen.
b) 2-metüül-2-penteen ja 1-etüültsüklopenteen.
c) 2-metüül-3-penteen ja 1-etüültsüklopenteen.
d) 2-metüül-1-penteen ja 2-etüültsüklopenteen.
e) 3-metüül-2-penteen ja 2-etüültsüklopenteen.
Õige alternatiiv: b) 2-metüül-2-penteen ja 1-etüültsüklopenteen.
2-metüül-2-pentanoolalkohol toodetakse 2-metüül-2-penteenalkeeni hüdreerimisel.
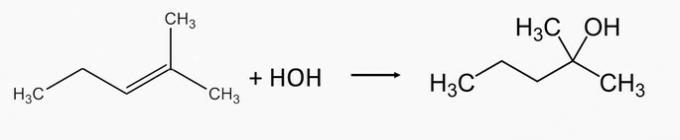
1-etüültsüklopentanoolalkohol tekib 1-etüültsüklopenteenalkeeni hüdratatsiooni teel.
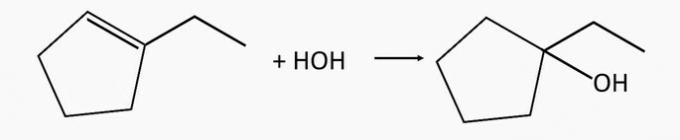
2. küsimus
(Ufal / 2000) Süsinikuühendite keemia uurimisel saab teada, et BENSENE:
() See on süsivesinik.
() Saab atsetüleenist.
() Naftas on see suurema massiprotsendi komponent.
() Võib läbida asendusreaktsiooni.
() See on resonantsi esitava molekulaarstruktuuri näide.
(TRUE) Benseen on aromaatne süsivesinik. Selle ühendi moodustavad ainult süsiniku ja vesiniku aatomid, mille valem on C6H6.
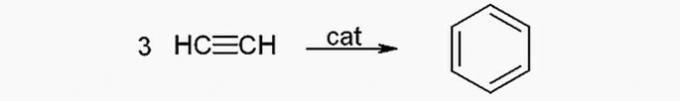
(TRUE) Benseeni saab atsetüleenist toota järgmise reaktsiooni abil:
(FALSE) Nafta on süsivesinike segu ja komponentide mass on seotud keti suurusega. Seega on suuremate süsinikahelate mass suurem. Nafta raskemates fraktsioonides, näiteks asfaldis, on rohkem kui 36 süsinikuaatomiga ahelad.
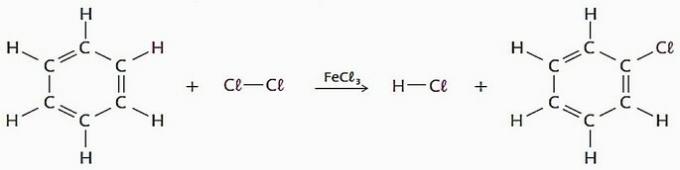
(TRUE) Asendusreaktsioonidel, milles reaktiivina kasutatakse benseeni, on palju tööstuslikke rakendusi, peamiselt ravimite ja lahustite tootmiseks.
Selles protsessis võib vesiniku aatomi asendada halogeenide, nitrogrupiga (-NO2), sulfoonrühm (—SO3H) teiste hulgas.
Vaadake seda tüüpi reaktsioonide näidet.
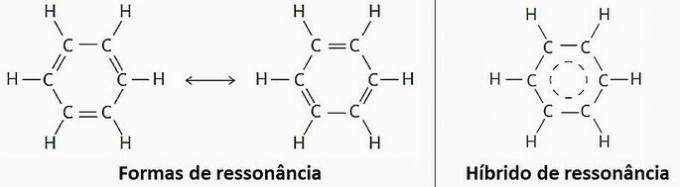
(TÕENE) Resonantsi tõttu võib benseeni kujutada kahe struktuurivalemiga.
Kuid praktikas on täheldatud, et süsinikuaatomite vaheliste sidemete pikkus ja energia on võrdsed. Seetõttu on resonantshübriid tegelikule struktuurile kõige lähemal.
3. küsimus
(UFV / 2002) Molekulaarse valemiga C alkoholi oksüdatsioonireaktsioon5H12O ‚koos KMnO-ga4 andis ühendi valemiga C5H10O.
Märkige suvand, mis näitab ÕIGE korrelatsiooni alkoholi nimetuse ja moodustunud toote nimetuse vahel.
a) 3-metüülbutaan-2-ool, 3-metüülbutanaal
b) pentaan-3-ool, pentaan-3-oon
c) pentaan-1-ool, pentaan-1-oon
d) pentaan-2-ool, pentanaal
e) 2-metüülbutaan-1-ool, 2-metüülbutaan-1-oon
Õige alternatiiv: b) pentaan-3-ool, pentaan-3-oon.
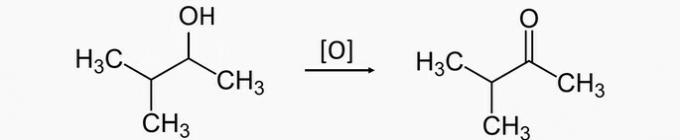
a) VALE. Sekundaarse alkoholi oksüdeerimisel tekib ketoon. Seetõttu on 3-metüülbutaan-2-ooli oksüdatsiooni õige produkt 3-metüülbutaan-2-oon.
b) ÕIGE. Sekundaarse pentaan-3-ooli oksüdeerimisel tekib pentaan-3-oonketoon.

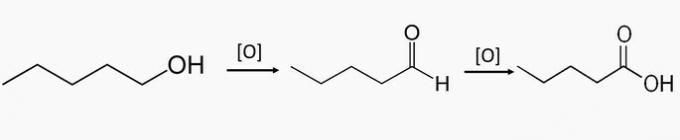
c) VALE. Need ühendid on osa primaarsete alkoholide oksüdeerumisest, mis tekitab aldehüüdi või karboksüülhapet.
Pentaan-1-ool on primaarne alkohol, ühendi osalisel oksüdeerumisel võib tekkida pentanaal ja koguoksüdatsiooni teel moodustada pentaanhape.
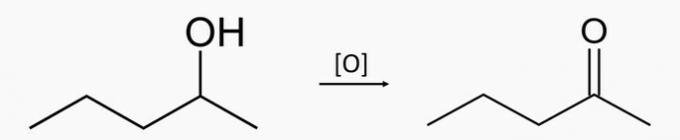
d) VALE. Sekundaarse pentaan-2-ooli oksüdeerimisel tekib pentaan-2-oonketoon.
e) VALE. Primaarne alkohol-2-metüülbutaan-1-ool toodab aldehüüdi 2-metüülbutanaali osalises oksüdatsioonis ja 2-metüülbutaanhapet täielikus oksüdatsioonis.
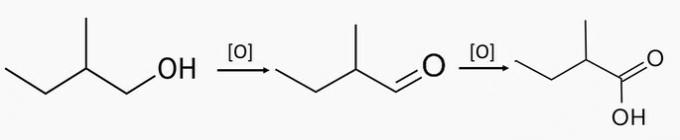
4. küsimus
(Mackenzie / 97) Elimineerimisreaktsioonis, mis toimub 2-bromobutaanis kaaliumhüdroksiidiga alkoholikeskkonnas, saadakse kahe orgaanilise ühendi segu, mis on positsioonisomeerid.
Üks neist, mida moodustub vähemas koguses, on 1-buteen. Teine on:
a) metüülpropeen.
b) 1-butanool.
c) butaan.
d) tsüklobutaan.
e) 2-buteen.
Õige alternatiiv: e) 2-buteen.
Alkaanid saadakse orgaanilise halogeniidi HBr reageerimisel kaaliumhüdroksiidiga KOH lahusti etüülalkoholi manulusel.

Erinevad ühendid tekkisid tänu sellele, et halogeeniaatom oli süsinikuahela keskel, tekitades rohkem kui ühe eliminatsiooni võimaluse.
Ehkki toodetel on kaks võimalust, ei moodustu neil sama kogus.
Selle reaktsiooni jaoks moodustub 2-buteen suuremas koguses, kuna see tuleneb tertsiaarse süsiniku elimineerimisest. 1-buteen tekkis primaarse süsiniku elimineerimisel ja seetõttu tekkis väiksem kogus.


