Orgaanilised ühendid on molekulaarsed, see tähendab, et nende aatomid kannavad üksteisega kovalentseid sidemeid. Analüüsides süsinike vahelisi sidemeid, mis võivad olla ühe-, kahe- või kolmekordsed, täheldame, et need on mittepolaarsed sidemed, kuna aatomite vahel pole elektronegatiivsuses erinevust, kuna need kuuluvad samasse element.
Veelgi enam, kuna vesinikul ja süsinikul on väga väike elektronegatiivsuse erinevus, on ka nende vahelised sidemed mittepolaarsed.
Mittepolaarsed ühendused:
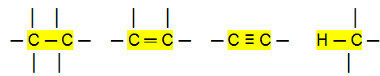
Selle põhjal võime järeldada, et Süsivesinikud (orgaanilised ühendid, millel on ainult süsiniku ja vesiniku aatomid) on mittepolaarsed molekulid. Nendes ühendites on molekulidevaheline interaktsioon indutseeritud dipooltüüpi, mis on kõige nõrgem.
Kuna need on nõrgad, on neid koostoimeid lihtne katkestada. Selle tõttu, süsivesinike keemis- ja sulamistemperatuurid on madalamad kui muude funktsioonide omad.

Süsivesinike võrdlus keemispunktid tõusevad, kui suureneb ka molaarmass.
Näiteks etaan ja butaan on mõlemad alkaanid. Vaadake iga katseliselt määratud keemistemperatuuri:
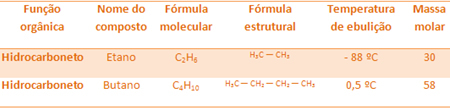
Pange tähele, et butaani keemistemperatuur on palju kõrgem kui etaani temperatuur, kuna ka selle molaarmass on suurem.
Kui võrrelda süsivesinikke, millel on sama moolimass (need on isomeerid), kuid millel on erinevat tüüpi süsinikahelad, mõistame, et mida suurem on okste arv, seda madalam on keemistemperatuur, kuna molekuli struktuur muutub kompaktsemaks, see tähendab, et selle pind väheneb.
Kõigil allpool toodud alkaanidel on sama molekulivalem C5H12, kuid nende keemistemperatuurid on erinevad:
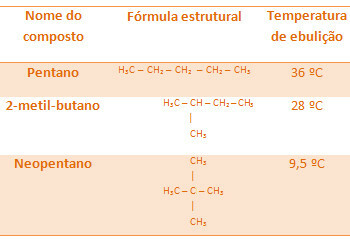
Pange tähele, et neopentaani keemistemperatuur on madalaim, kuna sellel on rohkem harusid.
Võime arvestada, et muud orgaanilised funktsioonid tulenevad süsivesinikest ühe või mitme vesiniku asendamise teel teiste elementide aatomite või aatomirühmadega. Üldiselt on teistes orgaanilistes funktsioonides hapnik või lämmastik, mis on rohkem elektronegatiivsed elemendid kui süsinik. Nad meelitavad tugevamalt süsinikuga jagatud elektronipaari ja muudavad seetõttu molekuli polaarseks:
Polaarühendused:
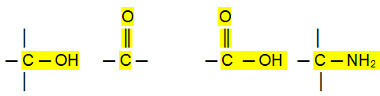
Aldehüüdide, ketoonide ja orgaaniliste halogeniidide keemistemperatuur on kõrgem kui süsivesinikud, kuna nende molekulidevaheline vastasmõju on püsiv dipool, mis on tugevam kui indutseeritud dipool.
Alkoholidel, karboksüülhapetel ja amiinidel on seevastu veelgi kõrgemad keemistemperatuurid, kuna need viivad läbi vesiniksidemeid, mis on kõige intensiivsem molekulidevaheline interaktsioon.
Kõigi nende funktsioonidega ühendites kehtib sama, mida nägime süsivesinike puhul:

Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm
