Kloriidid on need ioonsed ühendid, mis sisaldavad aniooni Cℓ-1.
Kloor kuulub 17 või 7A perekonda, selle aatomnumber on võrdne 17 ja valentskoores (aatomi välimine elektronkest) on 7 elektroni. Vastavalt reegel oktetti, stabiilsuse tagamiseks peab sellel viimases kestas olema 8 elektroni ja seetõttu peab ta vastu võtma veel ühe elektroni. Kui see juhtub, see tähendab, et kui ta saab elektroni, tavaliselt ioonsidestusest metalliga, moodustub â.ioonkloriid (Cℓ-1), muutub elektronist loobunud metall katiooniks ja moodustunud aine on ioonne.
Kloriidid on soolad, mis on saadud aluse reageerimisel vesinikkloriidhappega (HC2(siin)). Alus annab katiooni ja vesinikkloriidhape annab kloriidiooni:
Üldine alus + vesinikkloriidhape → Kloriid + vesi
ÇOH + HCℓ → ÇCℓ + H2O
Kloriidid on kõik klassifitseeritud anorgaanilised soolad, kuna vesikeskkonnas vabastavad nad muu katiooni kui H+ ja vabastage kloriidioonioon, mitte hüdroksüül (OH-).
Kloriidide nomenklatuur järgib alati seda reeglit: Kloriid +de + (klooriga seotud elemendi nimi).
Kell teie valemid on moodustatud ioonlaengute vahetamine indeksite vastu (number, mis asub elemendi sümboli paremas alanurgas, mis näitab selle elemendi aatomite arvu, mis on sidemeid moodustamas).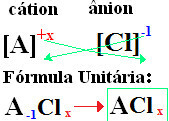
kui indeks on "1", ei pea te seda valemisse kirjutama, nagu allpool näidatud:
Kell+1 Cℓ-1 → Kell1Cℓ1 → KellCℓ: naatriumkloriid;
K+1 Cℓ-1 → KCℓ: kaaliumkloriid;
Siin+2 Cℓ-1→CaCℓ2: kaltsiumkloriid;
Ba+2 Cℓ-1→ Bsiin2: baariumkloriid;
Aℓ+3 Cℓ-1→ACℓ3: alumiiniumkloriid.
Kuid nagu selgitatud tekstisRühma ioonsed ained: kloriid, karbonaat, nitraat ja sulfaat”, Nagu kõigi ioonainete puhul, pole ka kloriidide ühtsed valemid looduses isoleeritud, kuna nende ioonid tõmbavad üksteist vastastikku ja moodustavad kristallvõre.
Peamine näide kloriidist, mis meil igapäevases elus on, on naatriumkloriid, NaCℓ, lauasool. Vaadake selle moodustumise ioonsidet (milles naatrium annetab kloorile elektroni) ja selle soola kristallvõre all:
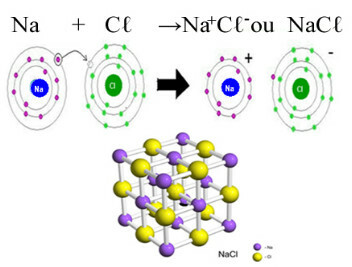
Naatriumkloriidi kristallvõrgus iga anioon Cℓ- on ümbritsetud 6 katiooniga Na+ ja vastupidi, seega on selle kristallvõre koordinatsiooninumber 6.
Kõik kloriidid on tahked ained ümbritsevates tingimustes ja üsna vees lahustuv, kuuludes meie igapäevases elus kõige tavalisemate soolade hulka, arvestades, et mitu neist on lahustunud mineraalvees, joogivees, kraanivees, jõgedes, meredes teised. Eranditest on vees lahustumatud kloriidid hõbekloriid (AgCℓ - näidatud alloleval joonisel), alates plii, vase ja elavhõbeda ühendid.

Vees lahustumatu hõbekloriid *
Cℓ ioonid-1 kloriididest, mida me sisse sööme, peamiselt sool, kala ja liha, on olulised inimkeha mõningate funktsioonide jaoks, kuna need on mahlas peamiselt rakuvälised anioonid maos, reguleerivad kehavedelikke, näiteks vee jaotumist kehas, ning säilitavad plasma osmootse rõhu ja neutraalsuse elektriline.
Selle puudus võib põhjustada ärevust, kõhulahtisust ja vereringehäireid. Selle ülejääk eritub uriini (keskmiselt iga inimene päevas umbes 4 g kloriidi), higi ja väljaheidete kaudu.
*Pildikrediit: Autor: Danny S. / Pilt on välja võetud: Wikimedia Commons
Autor Jennifer Fogaça
Lõpetanud keemia