THE elektronegatiivsus see on aatomi kalduvus meelitada elektrone enda poole, kui see on seotud mõne teise keemilise elemendiga. läbi kovalentse sideme, see tähendab, kus toimub elektronide jagamine, pidades seda molekuli isoleeritud.
Vaatleme esitatud näite paremaks mõistmiseks kahte näidet:
1. näide: vesinikgaasi molekul: H2 → H - H
Kui kaks vesinikuaatomit kokku saavad, tekivad kummagi tuuma vahelised tõmbejõud korraga. üks neist aatomitest teise aatomi elektroni poolt ning tõukejõud elektronide ja nende kahe tuuma vahel aatomid. Kui need jõud jõuavad tasakaalu, on need kaks elektrosfääride piirkonnas, mis asub kusagil nende kahe vahel. molekuli aatomid, milles mõlemad suhtlevad kahe elektroniga, muutudes stabiilseks, st neil kahel aatomil on paar elektronid.
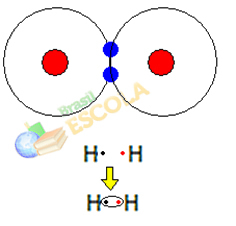
See on kovalentne side, mis moodustab molekuli. Kuid kuna selle molekuli kaks aatomit on täpselt ühesugused, on ka see, kuidas nad elektronid üksteise külge meelitavad. Nii et me ütleme seda elektronegatiivsuse erinevust pole või et ta see on apolaarne.
2. näide: vesinikkloriidmolekul: HC2
Sel juhul toimub elektronpaari jagamine erinevate elementide vahel, kuna sellega seoses kloori aatom meelitab elektrone suurema intensiivsusega kui vesinik. Seetõttu ütleme, et kloor on rohkem elektronegatiivne kui vesinik.
Nagu on näidatud alloleval joonisel, on elektronegatiivsuse erinevuse tõttu a elektriline dipool (μ), mis on kaks elektrilist monopoli, kusjuures elektrone kipub kloor rohkem köitma. Seega on sidemel H ─ Cℓ kloori osaline negatiivne laeng (δ-) ja osaline positiivne vesiniku laeng (δ+). Nii et see on molekul elektronegatiivsuse erinevusega ja on polaarne:
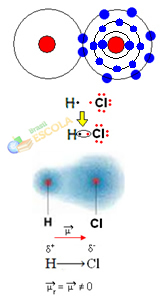
See näitab meile, et elektronegatiivsus on suhteline suurus, mitte absoluutne, kuna see määratakse, võttes arvesse aatomite poolt kovalentses sidemes avalduvate jõudude võrdlusi.
Elektronegatiivsuse arvutamiseks on mitu võimalust, kuid kõige tavalisem on see Paulingi pakutud elektronegatiivsuse skaala. Oletame, et meil on üldmolekul A ─ B. Pauling tegi ettepaneku, et selle molekuli sidumisenergia, mida sümboliseerib D, saadakse seonduvate energiate aritmeetilise keskmise summana (D) nende kahe aatomi gaasimolekulide, see tähendab A-A ja B-B, selle molekuli iga aatomi elektronegatiivsuste erinevuse ruuduga (xTHE ja xB):
Ärge lõpetage kohe... Peale reklaami on veel;)
D(A-B) = [D(A-A) + D(B-B)] + k (xTHE - xB)2
Konstant k ülaltoodud valemis on võrdne 96,5 kJ. mol-1. Pauling määras vesiniku elektronegatiivsusele meelevaldse väärtuse, mis oli 2,1, ja sel viisil oli võimalik avastada teiste elementide elektronegatiivsuse väärtus seoses ta.
Selle meetodi põhjal anti perioodilise tabeli elementidele, välja arvatud väärisgaasid, Paulingi elektronegatiivsuse väärtused.

Pange tähele, et need väärtused on perioodiline omadus, kuna need varieeruvad perioodiliselt elementide aatomnumbrite põhjal. Vaadake näiteks, et kõige rohkem elektronegatiivseid elemente on tabeli paremas ülanurgas olevad elemendid, see tähendab fluori (4,0) ja hapnik (3,5) ning kõige vähem elektronegatiivseid on alumises vasakus nurgas olevad frankium (0,8) ja tseesium (0,8).
Selle põhjal loodi isegi kõige rohkem töötavate elektronegatiivsete elementide elektronegatiivsuse rida:
F> O> N> C3> Br> I> S> C> P> H
Vaadake elektronegatiivsuse väärtusi:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Selle elektronegatiivsuse rea kaunistamiseks on omamoodi "trikk", mille annab allpool olev lause, kus iga sõna algustähis vastab kõnealuste elementide sümbolile:
“FTere Oei ole NO Clube, brsain MinasOeh Çsuremas Pjaoks Hhaigla "
Nii et võime seda öelda elektronegatiivsus on perioodiline omadus, mis suureneb perioodilisustabelis vasakult paremale ja alt üles.

Selle põhjuseks on aatomiraadiuse suurus. Mida suurem on aatomi raadius, seda kaugemal on jagatud elektronid tema tuumast ja seetõttu on nende vaheline külgetõmme nõrgem. Samuti on vastupidi, mida väiksem on aatomi raadius, seda lähemal on elektronid tuumale ja seda suurem on nende vaheline külgetõmme. Seega võime järeldada järgmist:
Elektronegatiivsus suureneb aatomi raadiuse vähenemisega.
Autor Jennifer Fogaça
Lõpetanud keemia