Sina oksiidid on binaarsed ühendid (koosnevad kahest keemilisest elemendist), kus hapniku aatomid on seotud teiste elementidega.
Üks ioonoksiid moodustub hapniku liitumisel metalliga, juba a molekulaarne oksiid, liitub hapnik mittemetalliga.
Mõned oksiidide näited on: rooste (raudoksiid III), vesinikperoksiid (vesinikperoksiid), lubi (kaltsiumoksiid) ja süsinikdioksiid (süsinikdioksiid).
Sellest lähtuvalt, vastavalt teatavate oksiidide käitumisele, liigitatakse need järgmisse:
| happelised oksiidid | (ametal + hapnik) |
|---|---|
| Alusoksiidid | (metall + hapnik) |
| Neutraalsed oksiidid | (ametal + hapnik) |
| Amfoteersed oksiidid | (anhüdriidid või aluselised oksiidid) |
| segatud oksiidid | (oksiid + oksiid) |
| Peroksiidid | (hapnik + hapnik) |
Oksiidide klassifikatsioon
Happelised oksiidid (anhüdriidid)
Mittemetallidest moodustunud happeoksiididel on kovalentne iseloom ja vee juuresolekul need ühendid tekitavad happed ja teiselt poolt moodustavad nad aluste juuresolekul soola ja vett.
Näited:
- CO2 (süsinikdioksiid või süsinikdioksiid)
- AINULT2 (vääveldioksiid)
Alusoksiidid
Metallid moodustavad aluselised oksiidid on ioonse iseloomuga ja reageerides moodustuvate hapetega sool ja vesi.
Näited:
- Kell2O (naatriumoksiid)
- CaO (kaltsiumoksiid)
Neutraalsed oksiidid
Mittemetallide poolt moodustatud neutraalsed oksiidid, mida nimetatakse ka “inertseteks oksiidideks”, on kovalentsed ja saavad selle nime, kuna nad ei reageeri vee, hapete ega aluste juuresolekul.
Näited:
- N2O (dilämmastikoksiid)
- CO (süsinikmonooksiid)
Amfoteersed oksiidid
Sellisel juhul on oksiididel eripära, mõnikord käituvad nad anhüdriididena (happelised oksiidid), mõnikord aluseliste oksiididena.
Teisisõnu käituvad need ühendid happe juuresolekul aluseliste oksiididena ja teisest küljest alusreageerivad happe oksiididena.
Näited:
- Al2O3 (alumiiniumoksiid)
- ZnO (tsinkoksiid)
segatud oksiidid
Sellisel juhul saadakse segatud oksiidid, topelt- või soolalahus, kahe oksiidi kombinatsioonist.
Näited:
- Usk3O4 (triferoontetraoksiid või magnetkivi)
- Pb3O4 (trilead tetraoksiid)
Peroksiidid
Neid moodustavad enamasti vesinik, leelismetallid ja leelismuldmetallid.
Peroksiidid on ained, mis koosnevad kahest hapniku aatomist, mis seonduvad omavahel ja seetõttu on nende valemis rühm (O).2)2-.
Näited:
- H2O2 (vesinikperoksiidi või vesinikperoksiid)
- Kell2O2 (naatriumperoksiid)
Loe ka: Anorgaanilised funktsioonid
Näited oksiididest
| CO | vingugaas |
|---|---|
| CO2 | süsinikdioksiid |
| H2O | Vesi või vesinikoksiid |
| Cl2O7 | dikloro heptoksiid |
| Kell2O | naatriumoksiid |
| lugeda2O | liitiumoksiid |
| Koer | kaltsiumoksiid |
| Hea | baariumoksiid |
| FeO | raudoksiid II või raudoksiid |
| Usk2O3 | raudoksiid III või raudoksiid |
| ZnO | tsinkoksiid |
| Al2O3 | alumiiniumoksiid |
| MnO2 | mangaandioksiid |
| Onu2 | titaan dioksiid |
| SnO2 | tina dioksiid |
| JUURES2 | lämmastikdioksiid |
| Nb2O5 | nioobiumoksiid V |
Oksiidi omadused
- Need on binaarsed ained;
- Kas üldvalem C2Oy, kus y on katiooni laeng (Cy +);
- Oksiidides on hapnik kõige elektronegatiivsem element;
- Need moodustuvad hapniku sidumisel teiste elementidega, välja arvatud fluor.
Loe ka: Keemilised funktsioonid
Peamised oksiidid ja nende rakendused
Vaadake allpool, kus kasutatakse mõnda oksiidi:

Oksiidide nomenklatuur
Üldiselt toimub oksiidi nomenklatuur järgmises järjekorras:
+ Elementi nimi oksiid koos hapnikuga
| Nimetus vastavalt oksiidi tüübile | |
|---|---|
| ioonoksiidid |
Fikseeritud laenguga oksiidide näited: CaO - kaltsiumoksiid Al2O3 - alumiiniumoksiid |
|
Muutuva laenguga oksiidide näited: FeO - raudoksiid II Usk2O3 - raudoksiid III | |
| molekulaarsed oksiidid |
Näited: CO - süsinikmonooksiid N2O5 - dinitrogeenpentoksiid |
Kurioosid
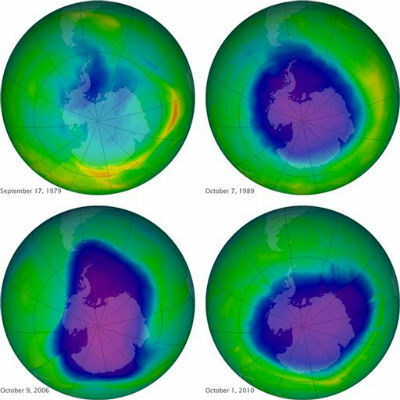
- Happevihm on õhusaastest põhjustatud nähtus. Seega on vihma happesuse suurendamise eest vastutavad mõned atmosfääris olevad oksiidid, nimelt: vääveloksiidid (SO2 ja nii3) ja lämmastikoksiidid (N2O, NO ja NO2).
- Binaarsed ühendid OF2 see on2F2 ei loeta oksiidideks, kuna fluor on hapnikust elektronegatiivsem element.
- Ehkki väärisgaasid on vähe reageerivad, on eritingimustes võimalik luua selle perekonna oksiide, näiteks ksenooni (XeO3 ja XeO4).
Kontrollige oma teadmisi oksiidide kohta sisseastumiseksami küsimuste ja ekspertide kommenteeritud tagasisidega: Anorgaaniliste funktsioonide harjutused.