Näeme selles tekstis, kuidas a graafik füüsilise seisundi muutus ükskõik millisele puhas aine, kuidas seda tüüpi diagramme tõlgendada ja kuidas on kujutatud segude graafik.
Selleks kaalume vee näidet. Kujutage ette, et võtame klaasi jäät temperatuuril –10 ºC ja alustame kuumutamist 1 atm rõhul. Kui temperatuur tõuseb -10 ºC -9 ºC, -8 ºC ja nii edasi, püsib jää tahkes olekus kuni 0 ° C-ni.
Sel hetkel hakkab see liikuma vedelasse olekusse, see tähendab, et toimub sulandumine. Temperatuur ei tõuse enam nagu varem, vaid püsib 0 ° C juures konstantsena, kuni kogu jää on sulanud:

Pärast kogu tahke aine sulamist jätkub süsteemi temperatuuri tõus kuni temperatuurini 100 ° C. Sellel temperatuuril hakkab vedelas olekus vesi muutuma auru olekuks, see tähendab, et see keeb.
Täpselt nii, nagu see juhtus sulandumispunkt, keemistemperatuuril jääb temperatuur samuti konstantseks, kuni kogu vedelik muutub auruks. Pärast seda, kui jätkame süsteemi soojendamist, tõuseb temperatuur jätkuvalt:
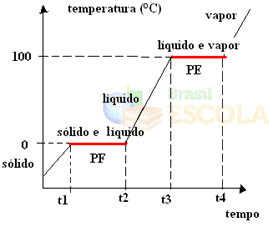
Valmis! See on graafik või diagramm, mis näitab vee füüsikalise oleku või selle kuumutuskõvera muutust. Kui see oleks pöördprotsess, oleks meil järgmine vesijahutuskõver:
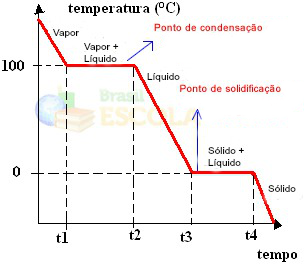
Nende graafikute väga oluline aspekt on see, et need on moodustatud kahest tasandist, see tähendab, et on kaks punkti, kus temperatuur püsib mõnda aega ühtlane. See juhtub alati puhta aine oleku muutumisel. Ainus erinevus on sulamis- ja keemistemperatuuri väärtused.
Ärge lõpetage kohe... Peale reklaami on veel;)
Näiteks hapnik, erinevalt veest, ei ole vedelik, vaid toatemperatuuril (umbes 20 ºC) gaas. Seda seetõttu, et selle sulamistemperatuur merepinnal on -223,0 ° C ja keemistemperatuur -183,0 ° C. Vaadake oma füüsilise seisundi muutuste tabelit:

Levinud segagraafika
Kui kuumutame või jahutame segu, pole sulamistemperatuuri ja keemistemperatuuri määratud ja konstantsed väärtused, see tähendab, et graafikutes vaadeldud kahte taset ei moodustata ülal.
Füüsikaliste olekute muutused toimuvad temperatuurivahemikes, mitte kindlas koguses. Näiteks sulamistemperatuur algab etteantud temperatuuril ja lõpeb teisel ja sama juhtub ka keemistemperatuuriga, nagu on näidatud järgmisel graafikul:
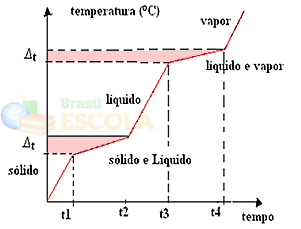
Kaks erandit on eutektilised ja aseotroopsed segud. Vaadake, mis nendega juhtub:
a) eutektiline segu
Eutektiline segu käitub sulamise ajal nii, nagu oleks see puhas aine, see tähendab, et sellel hetkel jääb temperatuur agregeerimisseisundi muutumise algusest lõpuni konstantseks.

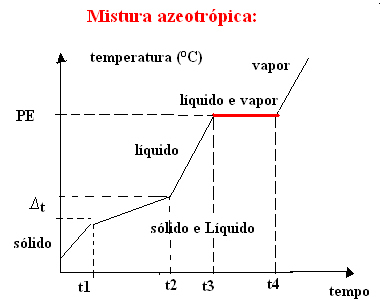
b) aseotroopne segu
Aseotroopne segu käitub keetmise ajal nagu puhas aine, see tähendab, et sel hetkel püsib temperatuur agregatsiooniseisundi muutuse algusest kuni lõpuni konstantsena.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Füüsikaliste olekumuutuste tabelid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/graficos-mudanca-estado-fisico.htm. Juurdepääs 28. juunil 2021.