entroopia on a ülevustermodünaamika seostatud pöördumatus füüsilise süsteemi olekutest. Seda seostatakse tavaliselt "häire"Või"juhuslikkusSüsteemi. Ühe avalduse kohaselt 2. termodünaamika seadus:
“Termiliselt isoleeritud süsteemis peab entroopia mõõtmine aja jooksul alati suurenema, kuni saavutab selle maksimaalse väärtuse. ”
Teisisõnu entroopia oskab mõõta "aja noolSüsteemi. Allpool olevaid pilte nähes teame intuitiivselt, et süsteemi algseisundit tähistab vasakule, suurimatest organisatsioon:
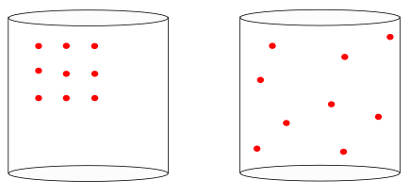
Eelmist pilti vaadates teame, et kõige tõenäolisem lõplik konfiguratsioon on see, milles aatomid on kiirused igas suunas, sama hästi kui juhuslikud positsioonid. Just see on entroopia: a paljusus süsteemi olekutest peab alati suurenema.
Näited
Milline alltoodud seadetest on tõenäolisem mida tuleb telliste paigutamisel aja jooksul jälgida?

Esimeses konfiguratsioonis paljusus plokkide olekutest on vähe: nad kõik on paigutatud suundhorisontaalne, paralleelselt üksteist. Aja möödudes või agendi toimimisel eeldatakse, et selle konfiguratsioon
kasva suureks aastal number aastal Osariikides, soosides Esmaspäevkonformatsioon, illustreeritud paremal pildil. Võib tuua muid näiteid:-
Kui jääkott pannakse anumasse koos suuremtemperatuur, selle temperatuur tõuseb, kuni see jõuab temperatuurini termiline tasakaal. Sel hetkel võib jää sulada. Võttes taas soojuse jääplokist, mis on nüüd olekus vedel, see võib uuesti tahkeks muutuda, kuid selle konformatsioon ei ole sama organisatsiooni mida varem esitati.
Ärge lõpetage kohe... Peale reklaami on veel;)
Parfüümipudeli avamisel võib kuumus aidata difusioon oma molekulid, parfüümi sisu levitamine kogu ruumi pikkuses. Vastupidi pole loota, sest soojuse eemaldamine ei soodustaks molekulide tagasitulekut kolbi.
Entroopia matemaatiline määratlus
THE matemaatiline määratlus entroopia annab soojushulga suhe (Q), mis on üle kantud soojusisolatsioonisüsteemi kahe osa vahel, džaulid (J) absoluuttemperatuuri järgi, Kelvin (K):

S = Entroopia (J / K)
ΔQ = Soojushulk (J)
T = Absoluutne temperatuur (K)
Eespool esitatud määratlus kehtib isotermilised protsessidsee tähendab, et soojusvahetused on nii väikesed (või aeglased), et nad ei suuda süsteemi temperatuuri muuta. Entroopia määratlus on nii lõpmatu väike (lõpmatult väike osa).
Entroopia mõistest saame aru ka järgmiselt: olles süsteem, mis on moodustatud sama gaasi kahest osast, aastal palju erinevaidtemperatuurid, on võimalik eraldada teatud kogus töö temast mõnda liigutamas kolb või käsi vänt, näiteks. Kuid, üle aja, kipuvad selle gaasi osad tasakaalsoojus. Kui temperatuurierinevust pole enam, isegi kogu seal oleva energia olemasolul, pole seda võimalik eraldada töökasulik temalt.
Autor Rafael Hellerbrock
Lõpetanud füüsika
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
HELERBROCK, Rafael. "Mis on entroopia?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm. Juurdepääs 28. juunil 2021.