Ideed aine (aatomi) koosseisu kohta tekkisid Vana-Kreekas, umbes 450 eKr. a., peamiselt Democritost ja Leucipost. Kuid aatomi sai teadusliku iseloomu tegelikult alles pärast nn Daltoni aatomiteooria.
THE Daltoni aatomiteooria see oli aatomiteadmiste arendamisel põhiline, kuna see oli aluseks teistele teadlastele aatomi ja selle omaduste tundmiseks.
Kes oli John Dalton?
Hariduselt keemik John Dalton sündis Inglismaal Cumbrias 1766 ja suri Manchesteris 1844. Juba varakult oli tema elu määratud teaduslikele uuringutele ja õpetamisele, nii et ta õpetas või aitas kaasa erinevate teadmiste valdkondade arendamisele.
Tema suurim pärand teadlasena oli aga esimese aatomiteooria väljatöötamine. Daltoni aatomiteooria tekkis 1808. aastal mitme gaaside segamise ja Lavoisieri pakutud teoste tundmisega seotud katse kaudu.
Daltoni aatomiteooria postulaadid
Daltoni aatomiteooria põhines katsetel, kuid ükski neist katsetest ei suutnud aatomit selgelt esile tuua. Seega nimetas Dalton aatomit aine väikseimaks osaks.
Daltoni teooria esitab palju rohkem postulaate kui tõestusi. Vaadake mõnda neist:
Aatomid on massiivsed ja kerakujulised (sarnased piljardikuuliga);
Aatomid on jagamatud;
Aatomid on hävimatud;
Üks keemiline element see on samade omadustega (suuruse ja massiga) aatomite komplekt;
Erinevate keemiliste elementide aatomitel on üksteisest erinevad omadused;
Nende eristamiseks saab kasutada kahe aatomi suhtelist kaalu;
Liitkemikaal moodustatakse erinevat tüüpi aatomite sama kombinatsiooni abil;
Erinevate aatomite ühendamisel moodustuvad erinevad keemilised ained.
Daltoni aatomimudeli esindused
Dalton nimetas oma aatomimudelit piljardikuuliks ja hakkas seetõttu kerakujuliste sümbolite abil esindama tema ajal tuntud elementide aatomeid.
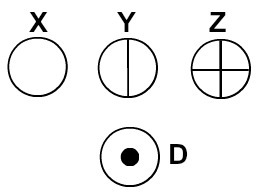
Daltoni aatomiteooria järgi esindatud aatomid
Iga konkreetse detailiga aatomiesitus näitab erinevat keemilist elementi. Didaktiliselt esindavad alg- ja keskastme raamatud ja harjutused aatomeid ainult erineva värvusega keradena.
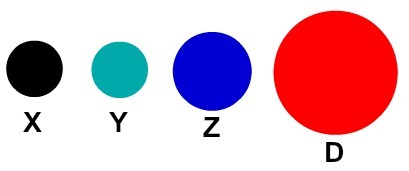
Aatomite didaktiline kujutamine
Daltoni aatomiteooria panused
-
mõistmine Lavoisieri missa säilitamise seadus
Ärge lõpetage kohe... Peale reklaami on veel;)
Prantsuse keemik Lavoisier väitis 1785. aastal, et “Keemilises reaktsioonis säilitatakse mass, kuna aatomeid ei looda ega hävitata ”. Daltoni aatomiteooria tõestas seda fakti, kuna üks tema postulaatidest väidab, et aatom on hävimatu.
Seega, kui kivisöe (C) põletamine toimub gaasilise hapniku (O2), on meil keemiline reaktsioon ühe süsinikuaatomi ja kahe hapniku aatomi vahel. See reaktsioon moodustab süsinikdioksiidi (CO2), millel on täpselt samad aatomid, mis moodustasid ained enne reaktsiooni.
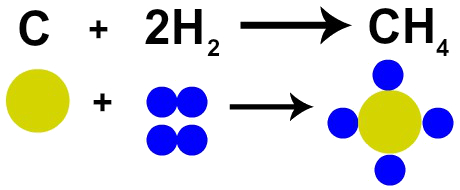
Lavoisieri seaduse kujutamine Daltoni aatomimudeli abil
mõistmine lihtsad ained
Kasutades Daltoni aatomimudel, saame aru lihtsast ainest, st sellisest, millel on sama omadusega aatomid, moodustades molekuli. Seetõttu on meil aatomid, mis kuuluvad samasse keemilisse elemendi.
Aines F2näiteks on meil kaks fluoriaatomit, seega peame kasutama Daltoni aatomiteooria järgi kahte tüüpi võrdseid aatomeid.

Ainete lihtne esitamine vastavalt Daltoni aatomimudel
mõistmine liitained
Liitaines moodustavad molekuli erinevad omadused. Seetõttu on meil aine moodustavad erinevad keemilised elemendid.
H aine2Näiteks O-l on kolm aatomit: kaks vesinikku ja üks hapnik. Vaadake selle esitust vastavalt Daltoni aatomimudelile:
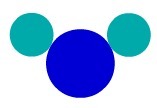
Liitainete kujutamine naha järgiDaltoni aatomimudel
Segude mõistmine
Daltoni aatomiteooria kaudu on segu (kahe või enama erineva aine liitumine) mõistmine lihtne: pange lihtsalt kaks erinevat molekuli ühte konteinerisse.

Teise segu kujutamine Daltoni aatomimudel
John Daltoni muud teaduslikud kaastööd
tutvustas mõiste aatommass;
Ta sõnastas gaaside osalise rõhu seaduse (Daltoni seadus);
Avastas nägemispuude nimega värvipimedus;
Uuris aurude ja gaaside käitumist erinevatel temperatuuridel;
Ta leidis, et kõik gaasid paisuvad (nad üritavad hõivata teatud kohta) ruumis ühtemoodi.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Daltoni aatomiteooria"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm. Juurdepääs 27. juunil 2021.