THE sp-tüüpi süsiniku hübridisatsioon see juhtub ainult siis, kui see loob kaks pi-sidet (π) ja kaks sigmasidet (σ). Sel juhul on siis kaks võimalust: süsinik võib luua kaks kaksiksidet või ühe- ja kolmiksideme, nagu allpool näidatud:
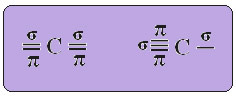
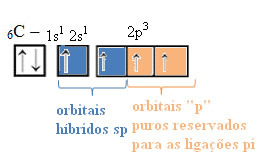
Teksti "sp tüüpi hübridisatsioon3”Näitab üksikasjalikult, kuidas toimub süsiniku hübridiseerimine. Mäletades: hübridisatsioon on puhaste aatomi orbitaalide „segamine“, mis tekitavad küll hübriidseid aatomi orbitaale, mis on üksteisega samaväärsed, kuid erinevad algsetest puhastest orbitaalidest. Nii juhtub süsiniku orbitaalides, mis olid algselt esindatud järgmiselt:
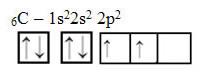
Kuid energia saamisel edendatakse 2s orbiidilt elektron (noolega tähistatud) 2p orbitaaliks:
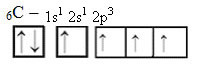
Nii on süsinikul neli paarimata orbitaali, mis suudab luua neli kovalentset sidet, mitte ainult kahte.
Sp-tüüpi hübridisatsiooni korral teame, et kaks sidet on pi; need esinevad puhtatel orbitaalidel p, samal ajal kui ülejäänud kaks orbitaali, mis on sp hübriidid, loovad ülejäänud sigmasidemed.
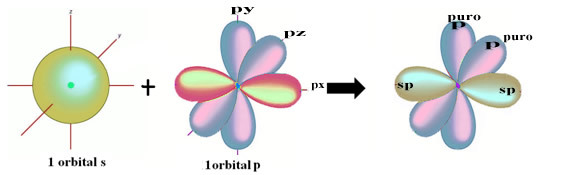
Selle hübridiseerimise s ja p orbitaali vahelist ruumilist kujutist, mis põhjustab hübriidse orbitaali, võib esitada järgmiselt:
Ärge lõpetage kohe... Peale reklaami on veel;)
Ülaltoodud joonisel on väga selge, et pi sidemeid moodustavad kaks puhast orbitaali.
Et saaksite aru, kuidas see juhtub, võtame näiteks tsüaniidgaasi (HCN) molekuli, mida kasutatakse Ameerika Ühendriikides surmanuhtlusele mõistetud vangide gaasikambrites. Selle struktuurivalemi annab:
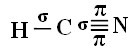
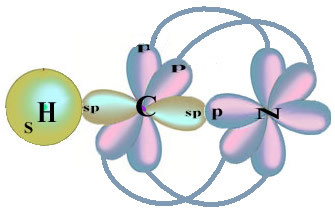
Mis puutub süsinikku, siis on selle aatomorbitaalid juba näidatud, vaadake nüüd vesiniku ja lämmastiku orbitaale:
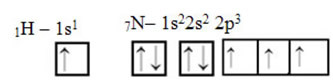
Pange tähele, et sigmassideme teostav paaristamata vesinikuorbiit on „s”, mida ruumiliselt esindab ring; ja lämmastikuorbitaalid on “p” tüüpi, mida tähistab kolm topeltmuna (mõlemad ruumiväljas: x, y, z). Seega on HCN molekuli struktuur järgmine:
Mis puutub selles formaldehüüdstruktuuris olemasolevate sidemete tüübisse, siis meil on:
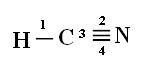
Ühendused: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Sp-tüüpi hübridisatsioon"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm. Juurdepääs 28. juunil 2021.