O naatriumkloriid (lauasool) on sool, mida kasutame oma igapäevaelus käsitööna valminud või töödeldud (tööstus) toidu soolaks. See on aine, mida leidub ka erinevates looduslikes toitudes, mida me igapäevaselt tarbime, näiteks puuviljad, köögiviljad, kaunviljad, seemned jne.
Selles tekstis saate teada kõike selle inimese igapäevase elu jaoks olulise aine kohta:
määratlus
Naatriumkloriid kuulub soolade anorgaanilisse funktsiooni ja koosneb naatriumkatiooni (Na+) see on anioon csealoreto (Cl-) läbi a iooniline side.
b) Keemilised omadused
Naatriumkloriidi moodustavad kaks keemilist elementi:
→ Naatrium (Na):
kuulub metallide (hõlpsasti katioone moodustavate) perekonda leeliseline (AI);
valentskoores on elektron;
aatomnumber on 11;
on kõrge elektropositiivsusega (võime kaotada elektrone).
→ kloor (Cl)
kuulub halogeenide perekonda (VIIA);
see on mittemetall (sellepärast saab sellest anioon nii lihtsalt);
valentskoores on seitse elektroni;
aatomnumber on 17;
on kõrge elektronegatiivsusega (võime elektrone saada).
Kuna kaks keemilist elementi, mis moodustavad naatriumkloriidi, on vastavalt kõrge elektropositiivsusega ja kõrge elektronegatiivsus, nende vahel on iooniline side (tekkinud aatomite vahel, millel on kalduvus kaotada ja saada elektronid).
Naatriumkloriidi keemiline struktuur koosneb ühest kloriidi anioonist (roheline kera), mis interakteerub kuue naatriumiooniga (sinised kerad), nagu võib näha allpool olevast struktuurist:
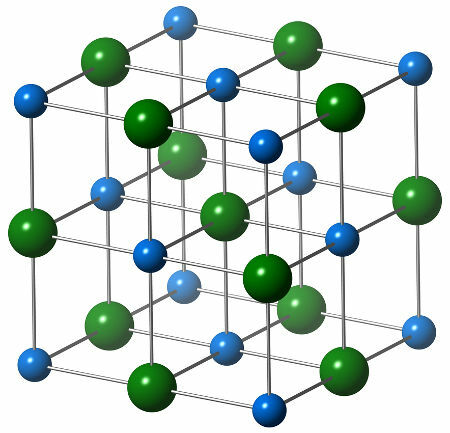
Naatriumkloriidi kristallstruktuuri kujutamine
c) füüsikalised omadused
Sulandumispunkt:
Naatriumkloriidi saab muuta tahkes olekus vedelaks temperatuuril 801 OÇ.
Keemispunkt:
Naatriumkloriidi saab temperatuuril 1465 muuta vedelast gaasiliseks OÇ.
Polaarsus
Kuna tegemist on ioonse sidemega tekkinud ainega, st kuna tegemist on ioonse ühendiga, on naatriumkloriid polaarne.
Lahustuvus vees
Me võime lahustada 1 L vees, temperatuuril 25 ° C OC, kuni 359 grammi naatriumkloriidi.
Lahustuvus teistes lahustites:
Kuna naatriumkloriid on polaarne ühend, ei saa seda lahustada üheski mittepolaarset laadi lahustis, näiteks õlis.
Tihedus:
Naatriumkloriidi tihedus on 2,165 g / ml, seetõttu on see tihedam kui vesi, mille tihedus on 1 g / ml.
Elektrijuhtivus:
Kuna tegemist on ioonse ühendiga, on naatriumkloriid elektrivoolu juhtiv ainult siis, kui:
-
See on sulas olekus, see tähendab vedel;
Ärge lõpetage kohe... Peale reklaami on veel;)
Lahustunud vees.
d) meetodid
Naatriumkloriidi võib saada füüsikaliselt või keemiliselt:
1O) Füüsiline:
murdkristallumine
Naatriumkloriid saadakse ookeanidest vee aurustamisel.
maa-alused miinid
See kaevandatakse kaevandustes kaevandamistehnika abil.
maa-alused maardlad
See ekstraheeritakse sügavatest maa-alustest sademetest vees lahustamise teel (maardlas olev sool lahustub) ja järgneva pumpamise teel.
2O) Keemiline hankimine
sünteesireaktsioon
Naatriumkloriidi võib saada sünteesi keemilisel reaktsioonil (lihtsad ained põhjustavad liitainet) gaasilise kloor- ja metallnaatriumi vahel:
2 sisses) + Cl2 g) → 2 NaCls)
Neutraliseerimisreaktsioon:
Teine viis naatriumkloriidi keemiliseks saamiseks on vesinikkloriidhappe ja naatriumhüdroksiidi neutraliseerimise reaktsioon, mille käigus moodustub sool ja vesi:
HCl(1) + NaOH(siin) → NaCl(siin) + H2O(1)
e) Tähtsus inimeste jaoks
Naatriumkloriidil pole iseenesest mingit funktsiooni, kuid see laguneb naatriumkatioonideks (Na+) ja kloriidanioonid (Cl-), on mõlemal neist kahest ioonist meie keha jaoks mitu olulist funktsiooni. Vaadake mõnda neist funktsioonidest:
→ Naatriumkatiooni funktsioonid (Na+)
Takistab vere hüübimist;
Võitleb neeru- ja sapikivide moodustumisega;
Osaleb kehavedelike reguleerimises;
Osaleb vererõhu reguleerimisel.
→ Kloriidaniooni funktsioonid (Cl-)
Osalemine maomahla moodustamises ja koostises (vesinikkloriidhape - HCl);
Osalemine pankrease mahla moodustamisel.
f) inimkeha kahjustused
Naatriumkloriidi liigne tarbimine võib inimestele põhjustada järgmist kahju:
→ Liigse naatriumkatioonide tekitatud kahjustus kehas:
Pikenenud haava paranemise aeg;
Suurenenud krambid;
Suurenenud vererõhk;
Neeru ülekoormus;
Suurenenud vedelikupeetus kehas.
→ Liigse kloriidanioonide tekitatud kahjustus kehas:
hävitamine E-vitamiin;
Joodi tootmise vähenemine kehas.
g) muud rakendused
Lisaks toidu soolaks kasutamisele võib naatriumkloriidi kasutada ka järgmistes olukordades:
Šampooni tootmine;
Paberitootmine;
Tootmine Naatriumhüdroksiid (NaOH);
Pesuvahendite tootmine;
Seebitootmine;
Lumesulamine kohtades, kus tuisk kannatab;
Metallilise naatriumi tootmine;
Kloorgaasi tootmine;
Keha elektrolüütide asendamise isotoonikas;
Nina dekongestantlahustes;
Soolalahuse tootmine; muude rakenduste hulgas.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Naatriumkloriid (lauasool)"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Juurdepääs 27. juunil 2021.
Ioonsed ühendid, ioonühendite põhiomadused, ioonide omavaheline sidumine, elektronide lõplik ülekanne, elektrostaatilised tõmbejõud ioonide, negatiivsete ja positiivsete ioonide, anioonide, katioonide, ioonsideme, molekulaarstruktuuri vahel ta
Keemia

Iooniline side, iooniliste ühendite, iooniliste aglomeraatide, naatriumkloriidi, lauasoola, ioonse aine, elektrostaatilised tõmbejõud, kloriidioonid, naatriumioonid, polaarsed lahustid, positiivsed ioonid, katioonid, negatiivsed ioonid, anioonid.