Spetsiifiline soojus on füüsika uuritud kogus, mis seob aine vastuvõetud soojushulka ja selle termilisi variatsioone.
Nimetatud ka soojusmahtuvus, see suurus näitab soojuse hulka, mis on vajalik grammi mis tahes aine muutmiseks temperatuur, mis vastab 1 ° C-le, lisaks materjali käitumise näitamisele soojusallikaga kokkupuutel.
Spetsiifiline soojus on otseselt seotud nn füüsika alaga Kalorimeetria, mis uurib energia ülekandeid kõrgema temperatuuriga kehast teise madalama temperatuuriga kehast.
Selles uuringus esineb erisoojus mõistliku soojuse ja soojusliku võimsuse määratluses materjal, kuna mõningaid nähtusi saab soojuse määratlusest paremini mõista spetsiifiline.
Ja mida suurem on erisoojus, seda suurem on soojuse hulk, mis tuleb ainest tarnida või eemaldada, nii et sellel on termiline variatsioon.
Näiteks vees on võrreldes teiste ainetega kõrgeim erisoojus, mis vastab 1 cal / g.ºC-le.
Spetsiifiliste soojusväärtuste võrdlustabel
Ka teistel ainetel ja materjalidel on oma erisoojusväärtused, nagu on näidatud allolevas tabelis:
| Aine | Spetsiifiline kuumus (cal / g.ºC) |
| Vesi | 1 cal / g. ° C |
| Etüülalkohol | 0,58 cal / g. ° C |
| Alumiinium | 0,22 cal / g. ° C |
| Õhk | 0,24 cal / g. ° C |
| Liiv | 0,2 cal / g. ° C |
| Süsinik | 0,12 cal / g. ° C |
| Plii | 0,03 cal / g. ° C |
| Vask | 0,09 cal / g. ° C |
| Raud | 0,11 cal / g. ° C |
| Jää | 0,50 cal / g. ° C |
| Vesinik | 3,4 cal / g. ° C |
| puit | 0,42 cal / g. ° C |
| Lämmastik | 0,25 cal / g. ° C |
| Hapnik | 0,22 cal / g. ° C |
| Klaas | 0,16 cal / g. ° C |
Spetsiifiline soojuse valem
Ainete erisoojuse tundmiseks on vaja kasutada järgmist valemit:
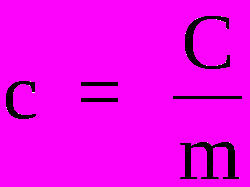
Kus
ç - erisoojus (cal / g ° C või J / Kg. K)
Ç - soojusvõimsus (cal / ° C või J / K)
m - mass (g või kg)
Rahvusvahelises süsteemis (SI) mõõdetakse erisoojust J / kg. K (džaul kilogrammi ja kelvini kohta). Kuid kõige sagedamini kasutatakse mõõtühikut cal / g ° C (kaloreid grammi ja Celsiuse kraadi kohta).
Vt ka tähendust kuumus ja temperatuur.