Kell keemilised sidemed on interaktsioonid, mis esinevad aatomite vahel, saades ühendi molekuli või põhiaine. Linke on kolme tüüpi: kovalendid, metallilised ja ioonne. Aatomid püüavad keemilise sideme loomisel end elektrooniliselt stabiliseerida. Seda protsessi selgitatakse okteti teooria, mis ütleb, et stabiilsuse saavutamiseks peab iga aatomi valentskoores olema kaheksa elektroni.
Keemilised sidemed ja oktettide reegel
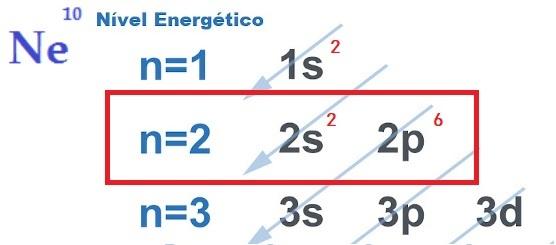
THE elektroonilise stabiilsuse otsimine, mis õigustab aatomitevaheliste keemiliste sidemete realiseerumist, on seletatav okteti teooria. Newton Lewise pakutud teooria väidab, et aatomi interaktsioon toimub nii, et iga element omandab väärisgaasi stabiilsuse, st kaheksa elektroni sisse valentsikiht.
Selle jaoks element anda, vastu võtta või jagada elektronid selle välimisest kestast, luues seeläbi ioonse, kovalentse või metallilise iseloomuga keemilisi sidemeid. Sina väärisgaasid nad on ainsad aatomid, mille välimises kestas on juba kaheksa elektroni ja seetõttu ei reageeri nad teiste elementidega eriti.
Vaataka: Elektroonilise levitamise reeglid: kuidas seda teha?
Keemiliste sidemete tüübid
Kaheksa elektronide saamiseks valentskoore, nagu on ette nähtud oktetti reegli järgi, ühenduvad aatomid omavahel, mis varieeruvad vastavalt elektronide annetamise, vastuvõtmise või jagamise vajadusele ja ka siduvate aatomite olemusele.
ioonsed sidemed
Tuntud ka kui elektrovalentsed või heteropolaarsed sidemedvahel juhtuda metallid ja väga elektronegatiivsed elemendid (ametalid ja vesinik). Seda tüüpi kõnes metallid kaotavad elektrone, muutumine katioonideks (positiivsed ioonid), ning mittemetallid ja vesinikuvõtu elektronid, muutumas anioonideks (negatiivsed ioonid).
Sina ioonsed ühendid on kõvad ja rabedad, kõrge keemistemperatuuriga ja käitumisvõimelised elektrivool kui nad on vedelas olekus või lahjendatud vees.
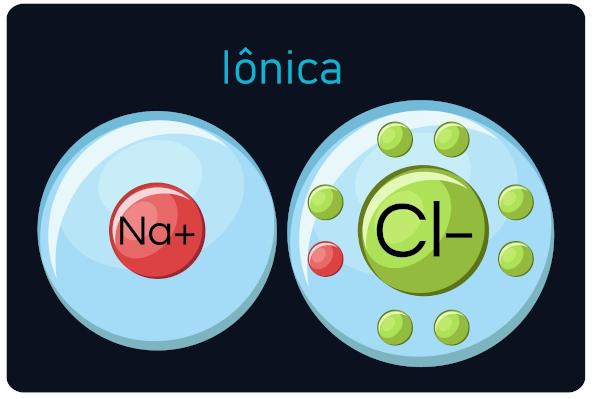
Tähelepanek: Pange tähele, et elektronid omandavast aatomist saab negatiivse märgiga ioon ja elektronid kaotanud aatomist positiivne märk.
Iooniliste ainete näited:
- Bikarbonaat (HCO3-);
- Ammoonium (NH4+);
- Sulfaat (SO4-).
Seda tüüpi keemiliste sidemete kohta lisateabe saamiseks külastage meie teksti: ioonsed sidemed.
Ärge lõpetage kohe... Peale reklaami on veel;)
kovalentsed sidemed
Kell kovalentsed sidemed toimuma elektronide jagamine. Seonduvate elementide väikese elektronegatiivsuse erinevuse tõttu ei loovuta ega võta nad vastu elektrone, vaid jagada elektroonilisi paare nii et nad oleksid okteti reegli järgi stabiilsed. Seda tüüpi ühendus on väga levinud lihtsates elementides nagu Cl2, H2, O2ja ka süsinikuahelates. erinevus elektronegatiivsus ligandide vahel määrab kindlaks, kas side on polaarne või mittepolaarne.

Loe ka:Molekulide polaarsus: kuidas tuvastada?
datatiivne kovalentne side
Nimetatud ka koordinaatkovalentne side, poolpolaarne, datiivne või koordinaatside, see on väga sarnane kovalentsele sidemele, nende kahe erinevus seisneb selles, et üks datatiivse sideme aatomitest vastutab kahe elektroni jagamise eest. Seda tüüpi ühenduste puhul toimub kunstlikult, omandab molekul spontaansest kovalentsest sidemest tulenevad molekuliga samad omadused.
Metallist lingid
Selline side toimub metallide vahel, mis sisaldavad 1A perekonna (leelismetallid), 2A (leelismuldmetallid) ja siirdemetallide (perioodilise tabeli plokk B - rühmad 3 kuni 12) elemente, moodustades selle, mida me nimetame metallisulamid. Diferentsiaalne tunnus muud tüüpi ühenduste suhtes on elektronide liikumine, mis seletab tõsiasja, et tahked metallmaterjalid on suurepärased elektri- ja soojusjuhid. Lisaks on metallisulamitel kõrge sulamis- ja keemistemperatuur, plastsus, vormitavus ja läige. Metallisulamite näited on:
teras: raud (Fe) ja süsinik C;
pronks: vask (Cu) + tina (Sn);
messing: vask (Cu) + tsink (Zn);
kuld: kuld (Au) + vask (Cu) või hõbe (Ag).

Kokkuvõte
- Keemilised sidemed: elektroonilist stabiilsust taotlevate aatomite vastastikune mõju
- Kõnede tüübid: ioonsed, kovalentsed ja metallilised.
- Okteti reegel: määratleb, et aatomi stabiilsuse tagamiseks peab selle valentskoores olema kaheksa elektroni.
lahendatud harjutused
küsimus 1 - (Mackenzie-SP) Väävel- ja kaaliumiaatomite elektroonilise konfiguratsiooni saamiseks väärisgaasiga on vajalik, et:
(Andmed: aatomnumber S = 16; K = 19).
a) väävel saab 2 elektroni ja kaalium 7 elektroni.
b) väävel annab 6 elektroni ja kaalium saab 7 elektroni.
c) väävel annab 2 elektroni ja kaalium 1 elektroni.
d) väävel võtab vastu 6 elektroni ja kaalium loobub 1 elektronist.
e) väävel võtab vastu 2 elektroni ja kaalium loobub 1 elektronist.
Resolutsioon
Alternatiiv E. Kuna väävel on perekonnas 6A või 16, peab oktetireeglit järgides omandama 2 elektroni, et valentskoores oleks 8. Seevastu perioodilise tabeli esimesse perekonda kuuluv kaalium (1A või vesinikuperekond), mille valentsikihis on väärisgaasi konfiguratsioon, peab ta kaotama 1 elektroni. Kombineerides 2 kaaliumi aatomit ühe väävliaatomiga, saame luua ioonilise sideme, milles mõlemad elemendid on elektriliselt stabiilsed.
2. küsimus - (UFF) Rinnapiim on toit, mis sisaldab palju orgaanilisi aineid, nagu valgud, rasvad ja suhkrud ning mineraalained, näiteks kaltsiumfosfaat. Nendel orgaanilistel ühenditel on oma molekulide moodustamisel peamisteks omadusteks kovalentsed sidemed, samal ajal kui mineraalil on ka iooniline side. Kontrollige alternatiivi, mis esitab õigesti vastavalt kovalentsete ja iooniliste sidemete mõisted:
a) Kovalentne side toimub ainult orgaanilistes ühendites.
b) Kovalentne sidumine toimub elektronide ülekandega ja ioonne seotus elektronide jagamisega vastassuunaliste pöörlemistega.
c) Kovalentne side tekib aatomite vaheliste laengute ja ioonse sideme abil laengu eraldamise teel.
d) Kovalentne side tekib aatomite ühendamisel molekulides ja ioonne side aatomite ühendamisel keemilistes kompleksides.
e) Kovalentne sidumine toimub elektronide jagamise teel ja ioonne sidumine toimub elektronide ülekandega.
Resolutsioon
Alternatiiv E.
Vaatame teisi:
- Alternatiiv: valed, kuna kovalentsed sidemed esinevad ka anorgaanilistes ühendites, näiteks CO-s2.
- Alternatiiv b: vale, kuna kovalentsed sidemed tekivad jagamisel ja ioonsed sidemed elektronide ülekandega.
- Alternatiiv c: Nii kovalentne kui ka iooniline seotus tekivad vajaduse tõttu kaotada või saada elektrone, mitte tuuma vahelise elektrostaatilise tõmbe kaudu.
- Alternatiiv d: Mõlemad sidemed, nii kovalentsed kui ioonsed, tekivad molekulis aatomite ühendamise kaudu.
3. küsimus - (PUC-MG) Vaadake üle tabel, mis näitab kolme aine, X, Y ja Z omadusi keskkonnatingimustes.
| Aine | Sulamistemperatuur (c °) | elektrijuhtivus | Lahustuvus vees |
| x | 146 | mitte ühtegi |
lahustuv |
| y | 1600 | kõrge | lahustumatu |
| z | 800 | lihtsalt sulanud või vees lahustunud | lahustuv |
Selle teabe põhjal on ÕIGE väita, et ained X, Y ja Z on vastavalt:
a) ioonne, metalliline, molekulaarne.
b) molekulaarne, ioonne, metalliline.
c) molekulaarne, metalliline, ioonne.
d) ioonne, molekulaarne, metalliline.
Resolutsioon
Alternatiiv C.
Aine X on molekulaarne, kuna molekulaarsidemed, mida nimetatakse ka kovalentseteks, on madal keemistemperatuur, kuna ligandite elektronegatiivsuse erinevus ei ole väga kõrge. Üldiselt pole kovalentsetel ühenditel elektrijuhtivust ja lahustuvus on erinev.
Aine Y võime tunnistada metalliliseks, kuna metallidel on kõrge sulamistemperatuur, need on suurepärased elektrijuhid ja vees lahustumatud.
Lõpuks on aine Z ioonne, kuna selle aine sulamistemperatuur on suhteliselt kõrge, mis on molekuli kristalse paigutuse tagajärg. Kui ioonne aine lahustatakse vees või vedelas olekus, on sellel vabad ioonid, mis muudab selle elektrone juhtivaks ja vees lahustuvaks.
Autor Laysa Bernardes Marques
Keemiaõpetaja


