Metallid on elemendid, mida iseloomustab heledus, tugevus, soojus- ja elektrijuhtivus. Nemad on praktiliselt kõikides tööstusprotsessides, olla metallisulamites, mida kasutatakse tööriistade, ehete ja müntide valmistamiseks ning keemilistes protsessides nagu redoks, mis vastutab korstnad ja patareid.
Perioodilisustabelis on need liigitatud:
semimetallid
siirdemetallid
leelismetallid
leelismuldmetallid
Terasetööstuses jagunevad need:
mustmetallid
värvilised metallid
raskemetallid
Loe ka: Millised on perioodilise tabeli uued elemendid?
Metallide omadused

Need on enamasti sooja ja elektrienergia suurepärased juhid.
Neil on läikiv välimus.
on kõrge tihedus.
Need on elektropositiivsed elemendid (kipuvad moodustama katioone - positiivseid laenguid).
Välja arvatud elavhõbe, need on kõrge sulamistemperatuuriga ja toatemperatuuril tahked elemendid.
Neil on mehaaniline tugevus (vastupidavus).
Need on vormitavad (neid saab vormida ilma purustamata).
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
Perioodiliste tabelite metallid
leelismetallid
Kas elemendid perioodilise tabeli esimene veerg, perekond 1A. Neid nimetatakse leelismetallideks, kuna veega segades moodustuvad nad hüdroksiidid, see tähendab leeliseline (aluseline) lahus.
Sina elemendid sellesse rühma kuuluvad:
Liitium li)
Naatrium (At)
Kaalium (K)
Rubiidium (Rb)
Tseesium (Cs)
Francio (pr)
Leelismetallide elektrooniline konfiguratsioon neutraalses olekus (laenguta / ioniseeritud) on ainult olemas elektron viimases kestas (valentsikiht). O aatomikiir ja nende metallide reaktsioonivõime suureneb ülevalt alla (jälgides metalli) Perioodilisustabel). Nende sulamistemperatuur on teiste metallidega võrreldes madal, nad on vormitavad ja mitte eriti tihedad, neil on kõrge oksüdeerumispotentsiaal.
Vaadake ka:Millised on aine omadused?
leelismuldmetallid
Need on elemendid, mis ilmuvad perioodilise tabeli teine veerg, perekond 2A. nimetatakse leeliseline muld kalduvus moodustada aluselisi (aluselisi) lahuseid ja maa, sest enne 19. sajandit tähistati nende ainete moodustunud oksiide nii. Seda mõistet kasutati lahustumatute metallide tähistamiseks, mis kuumutamisel mutatsiooni ei läbinud, 2. rühma elementide ühised omadused. Hiljem avastati uute uuringute ja katsete valguses, et “maa” elemendid olid tegelikult metallide moodustunud oksiidid.
Need on tempermetallid, madala tihedusega kaks elektroni selle välimises kestas, leitakse tavalistes temperatuuri ja rõhu tingimustes tahkes olekus. Kuuluge sellesse rühma:
Berüllium (Ole)
Magneesium (Mg)
Kaltsium (Siin)
Strontsium (hr)
Baarium (Ba)
Raadio (Konn)
siirdemetallid
moodustavad perioodilisustabeli rühm Bja asuvad leelismuldmetallide ja ametals. IUPAC määratles need elementidena, millel on mittetäielik energéticadi energeetiline alamkiht. Mõiste "siirdemetallid" viitab üleminek 2. rühmalt 13-le perioodilisustabelis ja elektronide suurenev lisamine orbiidile ‘d’.
Siirdemetallide rühm koosneb tihedatest elementidest, millel on kõrge sulamis - ja keemistemperatuur ning vähem reageeriv kui 1. ja 2. rühma metallid (Perekond 1A ja 2A). Siirdemetallide hulgas on volfram, mis on kõrgeima sulamistemperatuuriga (3422 ° C) element, ja elavhõbe (Hg), mis on metall, mis on normaalsetes temperatuuri- ja rõhutingimustes vedel, sulamistemperatuur on (-38,83 ° C).
Siirdemetallidel on erinevad oksüdatsiooniastmed (NOX muutuv) ja moodustavad värvilisi aineid.

Sisemised üleminekuelemendid
Sisemised üleminekuelemendid nemad on:
Lantananiidid: seeria, mis koosneb elementidest, millel on 57–71 prootonit ja mis, välja arvatud prometium, on looduslikud.
Aktiniidid: rühm, mille moodustavad elemendid vahemikus 89 kuni 103 aatomnumbris ja mis on enamasti sünteetilised. Kõik see rühm on radioaktiivne lühikese poolväärtusajaga.
Nende kahe rühma elementidel on kõrge sulamistemperatuur ja kõik need on toatemperatuuril tahked.
Poolmetallid
Sina semimetallid kokku on seitse elementi:
Boor (B)
Räni (Si)
Germaanium (ge)
Arseen (As)
Antimon (E)
Telluur (Te)
Poloonium (Po)
See klassifikatsioon antakse elementidele, millel on metallide ja ka muude kui metalliliste elementide füüsikalis-keemilised omadused. Semimetallid on läikivad, rabedad ühendid, mis on võimelised moodustama katioone ja ka anioone (sõltuvalt olekust) ning on vahejuhid.
Metallide tüübid
Raud: ained, mis sisaldavad oma koostises rauda. Nemad on metallisulamid mis sisaldavad ühise elemendina rauda, kuid mida saab formuleerida erineva kontsentratsiooniga süsinik, näiteks või on sepistatud erinevate tehnikatega, omades seega erinevate füüsikaliste omadustega tooteid.
Värvilised: sulamid, mis on moodustatud muud tüüpi metallidest, näiteks alumiinium, vask, nikkel, tsink, titaan.
Raskemetallid: plii, nikkel, tsink, elavhõbe. Need on reaktiivsed, mürgised ja bioakumuleeruvad metallid. Neid kasutatakse muuhulgas patareides, lampides, sõjaesemete laskemoonas.
Metallide keemilised sidemed
Metallid on elemendid elektropositiivnesee tähendab, et neil on kalduvus kaotada keemilisi sidemeid sisaldavaid elektrone. Kui metall suhtleb mittemetalliga, siis see sooritada iooniline side erinevuse tõttu elektronegatiivsus. Metallide teine sidumisvõimalus on metallisidemed.
Kell metallist ühendused metallide vahel, osaliselt vabanedes elektronidest ja moodustades aatomite ümber elektronide pilve või mere, mis tagab metallosadele juhtivus elektriline ja vormitavus.
Vaadake ka: Dirigendid ja isolaatorid - millised on erinevused?
Metallide hankimine
Enamik metalle on looduslikult leitud teiste elementidega seotud kivimid ja mineraalid. Metallide rafineerimiseks on mitu tehnikat, näiteks elektrolüüsi ja keemiliste reaktsioonide abil ühendite eraldamiseks.
Metallide puhul on kaks tööstuslikus ulatuses enim kasutatavat meetodit metalli teatud puhtusastme saamiseks: erinevus tihedus ja magnetiline vastuvõtlikkus (kalduvus, et metall peab reageerima a magnetväli).

lahendatud harjutused
Küsimus 1 - (Enem) Patareides sisalduv kaadmium võib maapinnale jõuda, kui neid materjale ebaseaduslikult keskkonda visatakse või kui neid põletatakse. Erinevalt metallilisest vormist on Cd2 + ioonid kehale äärmiselt ohtlikud, kuna need võivad asendada Ca2 + ioonid, põhjustades luudes degeneratiivset haigust, muutes need väga poorseks ja põhjustades luudes tugevat valu. liigesed. Nad võivad pärssida ka Zn2 + katioonil aktiveeritud ensüüme, mis on neerude töö jaoks äärmiselt olulised. Joonisel on näidatud mõnede metallide ja nende katioonide raadiuse variatsioon.
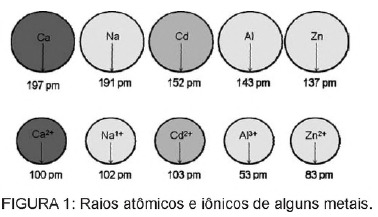
Teksti põhjal on kaadmiumi toksilisus ioonsel kujul selle elemendi tagajärg
A) madal ionisatsioonienergia, mis soodustab iooni moodustumist ja hõlbustab selle seondumist teiste ühenditega.
B) neil on kalduvus toimida bioloogilistes protsessides, mida vahendavad metallkatioonid laengutega vahemikus +1 kuni +3.
C) nende raadius ja laeng on suhteliselt lähedal metalliioonidele, mis toimivad bioloogilistes protsessides, põhjustades nendes protsessides häireid.
D) on suure ioonraadiusega, võimaldades tal sekkuda bioloogilistesse protsessidesse, milles tavaliselt osalevad väiksemad ioonid.
E) on +2 laenguga, mis võimaldab tal sekkuda bioloogilistesse protsessidesse, milles tavaliselt osalevad madalama laenguga ioonid.
Resolutsioon
Alternatiiv C. Kaadmium on element, mis sarnaneb metalliliste ioonidega, mis meil loomulikult kehas on. Lisaks bioakumuleerumisele võib kaadmium, millel on metallirühmadega sarnasus, seonduda molekulide sulfhüdrüülrühmadega valgu, põhjustades seeläbi muutusi bioloogilistes protsessides, nagu kaltsineerimine ning kudede ja punaste vereliblede hävitamine veri.
2. küsimus - Metallide jaoks oluliste omaduste jaoks märkige vale alternatiiv.
A) Enamik metalle on head elektri- ja soojusjuhid.
B) Mõned metallid on oksüdatsiooni ja / või redutseerimise suhtes vastuvõtlikud.
C) Raud on vastupidav ja tempermalmist metall, see tähendab, et seda on lihtne vormida.
D) Leelismuldmetallidel on see nimi „maa”, mis viitab nende metallide oksiididele, mis on tumedat värvi.
E) Metallid on oksüdatsiooni toimel erinevat värvi ja tuhmid elemendid.
Resolutsioon
Alternatiiv E. Metallid on loomulikult läikivad ja metallikvärvid, need võivad oksüdeeruda, mis põhjustab muutusi metaboliidi omadustes osa aspektist, kuid see pole nähtus, mis juhtub kõigis metallides ja mõnel juhul sõltub oksüdeerumine mitmest tegurist väline.
autor Laysa Bernardes
Keemiaõpetaja

