THE siduv energia on kaasatud vaheajalvõitreeningus ühe või mitme molekuli aatomite vahelise sideme. Näiteks vesinikgaasimolekulil on aatomite vahel üks side (sigma):

Vesinikgaasi struktuurivalem
Selle molekuli tekkimiseks tekkis selle aatomite vaheline üksikside. Kui see molekul osaleb keemilises reaktsioonis gaasilise klooriga (Cl2), näiteks vesinikkloriidhappe (HCl) moodustamiseks on H-s esinevad üksiksidemed2 ja Cl2 tuleb lagundada, mille tagajärjel moodustub HCl-is üksikside.
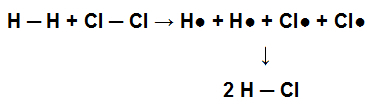
Esitatakse üksiksidemete purunemist reagendis ja üksiksideme moodustumist tootes
Aatomid seovad omavahel oma saavutamiseks elektrooniline stabiilsus, see tähendab, et nad liiguvad kõrgemast energiaolukorrast madalama energiaolukorda. Seega võime öelda, et aatomite vahelise sideme tekkimisel vabaneb energia; seetõttu sõltub selle lagunemine energia neeldumisest.
Kui sellest aru saame lahku minek keemilise sideme (purunemine) tekib siis, kui see sellele tarnitakse energiakogus (xKcal), jõudsime järeldusele, et see on protsess
endotermiline. Seevastu sideme moodustamine hõlmab vabastama annab sama kogus energiat (-xkcal), olles siis protsess eksotermiline.Meeldib keemilised reaktsioonid liigitatakse endotermiline või eksotermiline, saame kasutada teadmisi reaktantide ja saaduste molekulide sidumisenergia kohta keemilise protsessi energia muutuse (ΔH) määramiseks ja seejärel selle klassifitseerimiseks.
Näiteks vaadake alltoodud võrrandit:
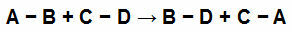
Keemilised sidemed keemilise võrrandi osalejates
Meil on igas reaktsioonis osalejas lihtsad lingid. Neil on järgmised väärtused:
[A-B] = 50 Kcal
[CD] = 100 Kcal
[B-D] = 80 Kcal
[B.C] = 230 Kcal
Ülaltoodud väärtuste abil saame arvutada reaktantide sidemete purustamiseks ja toodete sidemete moodustamiseks vajaliku energia järgmiselt:
Reagentides
50 Kcal AB-sideme purustamiseks ja 100 Kcal CD-sideme purustamiseks, st reagendis kasutatakse sidemete purustamiseks 150 Kcal.
Toodetes
80 Kcal BD sideme moodustamiseks ja 230 Kcal AC sideme moodustamisekssee tähendab, et sidemete moodustumisel eraldub tootes 310 Kcal
Reagentides ja produktides osalevate energiate väärtuste põhjal on võimalik teada saada, kas reaktsioon on neeldunud või vabastas rohkem energiat, lahutades katkestuses kasutatud energia energiast vabanenud energiast moodustamine:
ΔH = reaktiivide energia - toodete energia
ΔH = 230-310
ΔH = -80 Kcal
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
Kuna reaktsioonil eraldub rohkem energiat kui neeldub, on negatiivne ΔH seega eksotermiline.
MÄRGE: Kui osaleja stöhhiomeetriline koefitsient erineb 1-st, peame korrutama ühenduse energia väärtuse koefitsiendiga, näiteks:
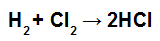
HCl moodustumise võrrand
Kuna HCl koefitsient on 2, peame HCl seondumise väärtuse korrutama 2-ga.
Nüüd järgige energia sidumise keemilises reaktsioonis harjutuse resolutsiooni:
Näide: Võttes arvesse järgmisi sidumisenergiaid, kilodžaulides sidememooli kohta (absoluutväärtused):
H - H = 436
N = N = 945,6
N - H = 391
Arvutage kuumus (kilodžaulides NH mooli kohta)3 g)) osalevad reaktsioonis, mida esindavad:
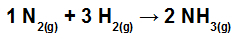
Keemilised sidemed NH moodustumisreaktsioonis3
Resolutsioon:
Selle harjutuse lahendamise esimene samm on kirjutatud võrrandi ümberkirjutamine, mis näitab igas molekulis esinevaid keemilisi sidemeid:
Ei N2: meil on kolmikside (kuna lämmastikuperekond N peab looma kolm sidet, kuna selle valentskoores on viis elektroni);
juures H2: Meil on ühekordne side (kuna H peab tegema ainult ühe sideme, kuna selle valentskoores on ainult üks elektron);
NH-s3: Meil on kolm lihtsat sidet (kuna iga H vajab sidet ja N kolm sidet).
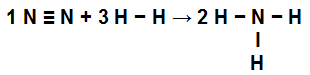
Võrrand, mis näitab seoseid NH moodustumisel3
Kuna harjutus esitas iga sidumise väärtused, tuleb kõigepealt kindlaks määrata iga osalejaga seotud seondumisenergia:
- N-le2
Meil on 1 mool aastal N2võrrandis ja teie ühenduse katkestamiseks vajame 945,4 KJ, seetõttu:
1.945,4 = 945,4 KJ
- H-le2
Meil on 3 mol aastal H2võrrandis ja teie ühenduse katkestamiseks vajame 436 KJ, seetõttu:
3.346 = 1038 KJ
- NH-sse3
Meil on 2 mol NH3võrrandis, kuid N-H side on kolm korda suurem, seega korrutame selle sideme moodustamiseks vajaliku energia hulga 2-ga ja 3-ga:
2.3.391 = 2346 KJ
Lõpuks saame määrata reaktsioonis osaleva soojuse, lahutades reaktandi purustamiseks kasutatud energia toote moodustamisel eralduvast energiast:
ΔH = energia reaktantides - energia toodetes
ΔH = (945,4 + 1038) - 2346
ΔH = 1983,4 - 2346
ΔH = - 362,6 KJ mooli NH kohta3 g)
Kuna variatsioon oli negatiivne, tähendab see, et produktides sidemete moodustumisel eralduv energia oli suurem kui reagentide sidemete purunemisel neeldunud energia, seetõttu reaktsioon on eksotermiline.
Minu poolt. Diogo Lopes Dias

