THE Anorgaaniline keemia määratleti esmakordselt Rootsi keemiku Torbern Olof Bergmani poolt 1777. aastal kui keemia osa, mis uurib mineraalide kuningriigist pärit ühendeid. See määratlus pakuti välja koos orgaanilise keemia (keemiat uuriva keemia) määratlusega elusolenditest pärinevad ained) eesmärgiga eristada orgaanilisi ühendeid anorgaanilised ained.
Praegune mõisteAnorgaaniline keemia é:
"Keemia haru, mis uurib anorgaanilisi ühendeid, mille koostises ei pruugi olla süsinik (moodustavad ahelad) ja vesinik."
Sina anorgaanilised ühendid on enamjaolt mõned olulised omadused, näiteks see, et nad on ioonne (välja arvatud kovalentsed anorgaanilised happed), tahked ained toatemperatuuril (välja arvatud vedelad anorgaanilised happed ja mõned gaasilised oksiidid) ja praegused metallid selle koostises (välja arvatud enamik anorgaanilisi happeid).
Anorgaaniliste ühendite omadused on seotud funktsionaalse klassiga, kuhu need kuuluvad. Nende saamine on seotud nende moodustamiseks vajalike keemiliste reaktsioonidega. Seetõttu on anorgaanilise keemia uuring jagatud mitmeks osaks:
-
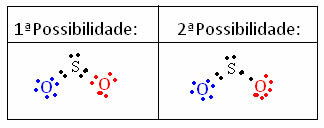
Happed: anorgaanilised ained, mis ioniseeruvad vees ja moodustavad hüdrooniumkatiooni;

Sidrunis sisalduv hape on anorgaanilise keemia uuritud aine näideÄrge lõpetage kohe... Pärast reklaami on veel rohkem;)
Alused: anorgaanilised ained, mis eraldama vees ja vabastage hüdroksüülanioon;
soolad: anorgaanilised ained, mis dissotsieeruvad vees ja eraldavad muud katiooni kui hüdroonium ja anioon, välja arvatud hüdroksüül;
Oksiidid: binaarsed ühendid, milles hapnikuelement on kõige elektronegatiivsem;
karbiidid: binaarsed ühendid, mis esitavad süsiniku elementi, mis on seotud metallide või poolmetallidega, kõige elektronegatiivsemaks;
Hüdriidid: binaarsed ühendid, milles vesinikelement on kõige elektronegatiivsem;
Neutraliseerimisreaktsioonid: keemilised reaktsioonid, mis tekitavad happe ja aluse koostoimest soolasid;
topeltvahetusreaktsioonid: keemilised reaktsioonid, mis tekitavad soola ja hapet, soola ja alust või kahte soola, alati nende samade ainete koostoimel;
Nihutusreaktsioonid: keemilised reaktsioonid, mis toodavad lihtsaid ja liitlikke aineid teistest lihtsatest ja liitainetest;
Röstimisreaktsioonid (keemilised reaktsioonid, mis hõlmavad sulfiidide põlemist)
Allpool toodud tekstides käsitletakse üksikasjalikumalt kõige erinevamate anorgaaniliste ainete omadusi ja ka keemilisi reaktsioone, mis hõlmavad nende saamise viise.
Minu poolt. Diogo Lopes Dias