A. Tugevuse uurimine hape on happelise lahuse elektrivoolu juhtimise võime määramiseks väga oluline, kuna see on seotud ioonide kogusega, mida see aine veega kokkupuutel tekitab (ionisatsioon). Kui hape on liiga tugev, tekitab see liiga palju hüdrooniumkatioone (H3O+) ja palju anioone (X-). Vaadake vesinikbromiidhappe ionisatsiooni võrrandit:
HBr + H2O → H3O+ + Br-
Ioniseerimisel reageerib happemolekulis sisalduv vesinik veemolekuliga ja moodustab hüdrooniumi. Kuid selle sündmuse toimumiseks peab vesinikuaatom tingimata olema ioniseeritav. Ioniseeritav vesinik on hüdrooniumkatiooni moodustamiseks võimeline.. Et teada saada, kas vesinik on ioniseeritav, võtame arvesse happe liigitamist vesinikhappeks (selle koostises pole hapnikku) või oksühappeks (koostises on hapnik).
a) hüdratiidid
Kogu vesinik vesinikus loetakse ioniseeritavaks.
Näited:
- HCl: ioniseeritav vesinik, tootes seega hüdrooniumit;
Ärge lõpetage kohe... Peale reklaami on veel;)
- H2S: kaks ioniseerivat vesinikku, seejärel tekivad kaks vesinikku
b) oksihape
Oksühappes ainult vesinik, mis on seotud molekuli hapnikuaatomiga, loetakse ioniseeritavaks. Selleks on vaja ehitada selle struktuurivalem. Vaadake mõnda näidet:
H3TOLM4 (fosforhappe)
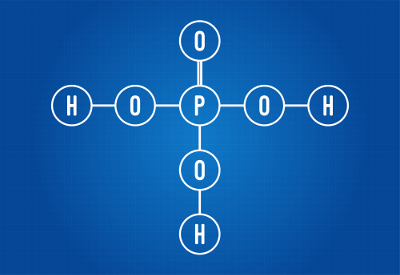
Fosforhappe struktuurivalem
Näeme, et fosforhappe struktuuris on hapnikuga seotud kolm vesinikku, seega on kolm ioniseeritavat vesinikku. Ionisatsioonivõrrand on järgmine:
H3TOLM4 + 3 H2O → 3H3O+ + PO4-3
H2AINULT4 (väävelhape)
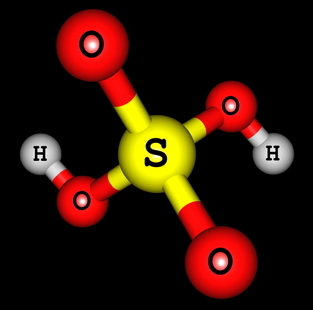
Väävelhappe struktuurivalem
Näeme, et väävelhappe struktuuris on kaks hapnikuga seotud vesinikku, seega on kaks ioniseerivat vesinikku. Ionisatsioonivõrrand on järgmine:
H2AINULT4 + 2 H2O → 2H3O+ + OS4-2
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Ioniseeritavad vesinikud"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/hidrogenios-ionizaveis.htm. Juurdepääs 28. juunil 2021.
Keemia

Dissociation and Ionization, Itaalia teadlane Volta, elektrivool, Rootsi füüsikaline keemik Svant August Arrhenius, teooria Arrhenius, positiivsed ioonid, katioonid, negatiivsed ioonid, anioonid, seebikivi, lauasool, polaarmolekulid, dissotsiatsioon ioonne,