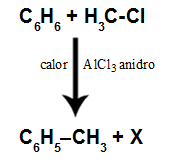
Joseph Lous Gay-Lussac (1778-1850) oli teadlane, kes uuris olulisi gaase. Ta viis läbi vee tootmise vesiniku ja hapnikugaaside vahelises reaktsioonis ja kontrollis, kas need toimivad reageeris alati kahe mahuosa vesiniku ja ühe mahu hapniku vahekorras, saades kaks mahuosa vesinikku Vesi:
Vesinik + hapnik → vesi
1. katse: 2 L 1 L 2 L
2. katse: 4 L 2 L 4 L
3. katse: 8 L 4 L 8 L
4. katse: 16 L 8 L 160 L
Pange tähele, et kõigis katsetes on suhe alati sama: 2: 1: 2.
Pärast mitmeid katseid ja analüüse mõistes, et sama juhtus ka muud tüüpi gaaside vaheliste reaktsioonidega, see tähendab reaktsioonidega järgis alati konstantset mahu suhet, jõudis see teadlane järgmisele gaasiliste mahtude reaktsioonide seadusele, mida nimetatakse Gay-Lussaci mahuõigus või Mahtude ühendamise seadus:

Gay-Lussaci mahuseaduse avaldus
Kuid see seadus oli vastu Daltoni aatomiteooria, mis ütles, et kõike moodustasid massiivsed ja jagamatud sfäärilised osakesed, aatomid. Selle teooria kohaselt peaks reaktsioonis olevate saaduste maht olema võrdne reagentide mahtude summaga. Seega peaks toimuma järgmine:
Vesinik + hapnik → vesi
2 köidet + 1 köide → 3 köidet
Kuid Gay-Lussac näitas, et praktikas see nii ei olnud, tulemus oli võrdne kahe mahuosa veeauruga.
Ärge lõpetage kohe... Peale reklaami on veel;)
Vastus sellele ilmsele vastuolule tuli hüpotees või Avogadro seadus.

Itaalias trükitud tempel näitab Amedeo Avogadrot ja tema seaduse kuulutamist 1956. aastal *
Amedeo Avogadro (1776-1856) näitasid, et tegelikkuses ei olnud gaasid mitte isoleeritud aatomid, vaid molekulid (välja arvatud väärisgaasid). Tema seadus ütles:

Avogadro seaduse avaldus
Avogadro näitas seda 1 mool mis tahes gaasist on 6.02. 1023 molekulid. See väärtus on tuntud kui Avogadro arv või konstant. On tõestatud, et tavalistes temperatuuri ja rõhu tingimustes (CNTP), kus rõhk on võrdne 1 atm ja temperatuur on 273 K (0 ° C), 1 mooli gaasi hõivatud maht on alati 22,4 l. See väärtus vastab väärtusele gaaside molaarne maht. Need suhted on väga olulised harjutuste lahendamiseks stöhhiomeetria.
See võib tunduda kummaline, sest võib tekkida järgmine küsimus: Kuidas saaksid erineva suurusega molekulide ja aatomitega gaasid hõivata sama mahu?
Noh, seda seetõttu, et gaasimolekulid on üksteisest nii kaugel, et molekulide suurus on tühine.
Nii seletas Avogadro mahuseadus Gay-Lussaci mahuseadust. Pange tähele, et kaks vesiniku molekuli (kaks mahtu) reageerivad ühe hapniku molekuliga (üks maht), moodustades kaks veemolekuli (kaks mahtu). Vee ja vesiniku maht on sama, kuna neil on sama kogus molekule, nagu on öeldud Avogadro seaduses.

Molekulide osakaal vee moodustumise reaktsioonis
Samal ajal muutis Avogadro seadus aatomiteooria püsti, kuna näete, et nii reaktantides kui ka produktides on kokku 6 aatomit (4 vesinikku ja 2 hapnikku).
Need mahuseadused olid mõiste väljatöötamiseks väga olulised molekulid.
* Pilt on autoriõigusega kaitstud: rook76 / Shutterstock.com
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Gay-Lussaci mahuseadus"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm. Juurdepääs 28. juunil 2021.
Mis on gaasid, millised on gaaside omadused, molekulaarsed ühendid, kokkusurutavus, fikseeritud maht, kineetiline energia keskmine, absoluutne gaasi temperatuur, ideaalne gaas, reaalsed gaasid, täiuslik gaas, gaasi oleku muutujad, gaasi maht, aastaajad
Keemia

Gay-Lussaci seadused, Prousti seadus, keemiline reaktsioon, pidev osakaal, ainemassid, puhas aine, analüüs kvalitatiivne ja kvantitatiivne, täiuslike gaaside seadus, konstantsete proportsioonide seadus, kindlate proportsioonide seadus, seadus mahuline.