Ioonide sidumine toimub ioonide vahel, nagu selle nimigi ütleb. Kuna neil on vastupidised laengud, tõmbavad katioonid (positiivse laenguga element) ja anioonid (negatiivse laenguga element) üksteist elektrostaatiliselt, moodustades sideme. Kuid ioonse tahke aine moodustavad katioonide ja anioonide aglomeraat, mis on organiseeritud täpselt määratletud geomeetriliste kujunditega, mida nimetatakse võrestikeks või kristallvõredeks.
Näiteks sool (naatriumkloriid) moodustub elektroni lõplikul ülekandmisel naatriumist klooriks, mis põhjustab naatriumkatiooni (Na+) ja kloriidanioon (Cl-). Praktikas ei hõlma see reaktsioon mitte ainult kahte aatomit, vaid tohutut ja määramatut arvu aatomeid, mis moodustavad kuupikujulise kristallvõre, nagu allpool näidatud:

Kui me vaatame soolakristalle skaneeriva elektronmikroskoobiga, siis näeme, et need on sisemise struktuuri tõttu tegelikult kuupmeetilised.

Kuna iga iooniline ühend koosneb seejärel määramatust ja väga suurest arvust ioonidest, kuidas me siis kujutame ioonset ühendit?
Tavaliselt kasutatakse valemit ühiku valem, mis on see, mis tähistab kristallvõre moodustavate katioonide ja anioonide väikseima võimaliku arvuga väljendatud osakaalu, nii et ühendi kogu laeng neutraliseeritakse. Selle toimumiseks on vajalik, et aatomi poolt loovutatud elektronide arv oleks võrdne teise aatomi vastuvõetud elektronide arvuga.
Mõned aspektid ioonühendite ühiku valemi kohta on olulised, vaata mõnda:
Ärge lõpetage kohe... Peale reklaami on veel;)
- Kirjutage alati kõigepealt katioon ja seejärel anioon;
- Kuna iga ioonühend on elektriliselt neutraalne, ei pea ioonlaenguid üles kirjutama;
- Iga iooni paremal küljel olevad alaindeksinumbrid näitavad katiooni aatomite ja aniooni suhet. Neid numbreid nimetatakse indeksiteks ja numbrit 1 ei kirjutata.
Näiteks naatriumkloriidi puhul on selle ühikuvalem NaCl, kuna meil on iga kloriidi aniooni jaoks täpselt 1 naatriumkatioon.
Vaadake veel ühte näidet, Al3+ on kolm positiivset laengut, samas kui F- sellel on ainult üks negatiivne, seega on ühendi neutraliseerimiseks vaja kolme fluoriidiooni. Seega järeldame, et selle ühikuvalem on AlF3.
Ioonse ühendi ühikuvalemi saamiseks on lihtne viis vahetada laengud indeksite vastu, nagu on näidatud allpool üldisel viisil:

Näited:

Teine ioonainete tähistamiseks kasutatav valem on Lewise valem või elektrooniline valem, mida tähistab elemendi sümboli ümber olevate "pallide" ioonide valentskestast pärit elektrone. Soola puhul on meil:

Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Jooniste võlakirjade esitamise valemid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm. Juurdepääs 28. juunil 2021.
b) Määrake x väärtus naatriumalumiiniumfluoriidi valemis.
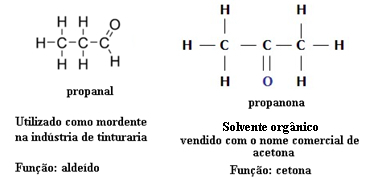
Ioonsed ühendid, ioonühendite põhiomadused, ioonide omavaheline sidumine, elektronide lõplik ülekanne, elektrostaatilised tõmbejõud ioonide, negatiivsete ja positiivsete ioonide, anioonide, katioonide, ioonsideme, molekulaarstruktuuri vahel ta
Süsiniku ruumivalem, Lewise elektrooniline valem, tasapinnaline struktuur, elektroonilised paarid, side kovalentne, valentsikiht, aatomimudeli areng, molekulaarne valem, struktuurivalem, valemid kolmemõõtmeline.
Keemilised valemid, tasane struktuurivalem, siduri struktuurivalem, kolmikside, gaas lämmastik, elektrooniline valem, Lewise valem, molekulaarne valem, üksikside, kaksikside, gaas süsinik.
Keemia

Iooniline side, iooniliste ühendite, iooniliste aglomeraatide, naatriumkloriidi, lauasoola, ioonse aine, elektrostaatilised tõmbejõud, kloriidioonid, naatriumioonid, polaarsed lahustid, positiivsed ioonid, katioonid, negatiivsed ioonid, anioonid.