Sina aldehüüdid ja ketoonid need on väga sarnased orgaanilised funktsioonid. Mõlemal on oma struktuuris karbonüülfunktsionaalne rühm (C = O), ainsa erinevusega, mis aldehüüdid, on see alati süsinikuahela lõpus, see tähendab, et üks karbonüülsüsiniku ligandidest on vesinik; ketoonidel on karbonüül kahe teise süsinikuaatomi vahel.
Aldehüüdide funktsionaalne rühm:Ketoonide funktsionaalne rühm:
O O
║ ║
C C - H C C - C
Sel põhjusel esineb aldehüüdide ja ketoonide vahel funktsionaalset isomeeriat. Näiteks esitame allpool kaks funktsionaalset isomeeri, millel on sama molekulivalem (C3H6O), kuid üks on aldehüüd (propanaal) ja teine on ketoon (propanoon). Vaadake, kuidas see nende omadusi ja rakendusi täielikult muudab:
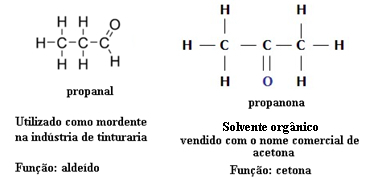
Aldehüüdi ja ketooni funktsiooniisomeeria näide
Kujutage ette, et olete laboris ja leiate värvitu vedelikuga viaali, millel on ainult molekulvalem C3H6O. Mida teeksite, et teada saada, kas see on ketoon või aldehüüd?
Selliste probleemide lahendamiseks on meetodeid aldehüüdide ja ketoonide eristamiseks, mis põhinevad nende ühendite reaktsioonil nõrkade oksüdeerivate ainetega
. Nagu allpool näidatud, nõrkade oksüdeerijatega silmitsi seistes reageerivad aldehüüdid oksüdeerumisega, samas kui ketoonid ei reageeri. Me ütleme niialdehüüdid toimivad redutseerijatena, kuid ketoonid mitte, nad reageerivad ainult redutseerijatena kokkupuutel energeetiliste oksüdeerijatega.Aldehüüdid + nõrgad oksüdeerijad → karboksüülhape
O O
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Ketoonid + nõrgad oksüdeerijad → Ärge reageerige
O
║
C ─ C ─ C + [O] → Reaktsiooni ei toimu
Sellest lähtuvalt piisab siis selle reaktsiooni läbiviimisest ja sellest, kas ühend reageerib või mitte. Kui see reageerib, teame, et see on aldehüüd; kui see ei reageeri, on see ketoon.
Lisaks on nendes aldehüüdi oksüdatsioonireaktsioonides moodustunud tooted üsna nähtavad, toimuvad värvimuutused, nagu hiljem näidatakse.
Aldehüüdide ja ketoonide eristamiseks on kolm peamist meetodit:
1 - Tollensi reaktiivne: See reagent on a hõbenitraadi ammoniaagilahus, st see sisaldab hõbenitraati (AgNO3) ja ammooniumhüdroksiidi liig (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3) OH + NH4JUURES3 + 2 H2O
Tollens Reactive (nimetatud Saksa keemiku Bernhard Tollensi (1841–1918) järgi)
Nagu tekstis selgitatud Hõbepeegli valmistamine, kui aldehüüd viiakse kokkupuutesse reaktiivse Tollensiga, oksüdeeritakse see vastavaks karboksüülhappeks, samal ajal kui hõbeioonid redutseeritakse Ag-ks0 (metallhõbe). Kui see reaktsioon viiakse läbi näiteks katseklaasis, ladestub see metallhõbe toru seintele, mille tulemusena moodustub kile, mida nimetatakse hõbedane peegel. See täheldatud tulemus on väga ilus ja seda kasutatakse tööstuslike peeglite valmistamise protsessis.
Ärge lõpetage kohe... Pärast reklaami on veel rohkem;)
Toimuvat reaktsiooni saab esitada järgmiselt:
O O
║ ║
R - C - H + H2O → R - C - OH + 2e- + 2 H+
2 a+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║║
R C - H + 2 a+ + 2 NH3 + H2O → R C - OH + 2 a0 + 2 NH4+
aldehüüd Tollenid reageerivadkarboksüülhape metallist hõbe (hõbe peegel)
Teiselt poolt, kui paneme ketooni reageerima Tollensi reaktiiviga, ei toimu metallhõbeda moodustumist, kuna ketoonid ei saa Ag ioone redutseerida.+.
2- Fehling reaktiivne: See reaktiiv on sinine vasksulfaadi II lahus (CuSO4) aluselises keskkonnas, kuna see on segatud teise naatriumhüdroksiidi (NaOH) ja naatrium- ja kaaliumtartraadi (NaOOC-CHOH-CHOH-COOK) moodustunud lahusega. Vase II sulfaadi lahusele lisatakse tartraat, et stabiliseerida seda ja vältida selle sadestumist.
CUSO4 + 2 NaOH → Na2AINULT4 + Cu (OH)2
Fehling Reactive (nimetatud Saksa keemiku Hermann von Fehlingi (1812–1885) järgi)
Fehlingi reaktiiviga kokkupuutes moodustab aldehüüd oksüdeerimisel karboksüülhappe, vaseioonid (Cu)2+) keskel esinevad redutseeruvad, moodustades punakaspruuni (rohkem tellisetaolist) sade, mis on vaskoksiid. Ketoonid seevastu ei reageeri - kuna nad ei suuda kuioone vähendada2+.
O O
║ ║
R - C - H + 2 Cu (OH)2 → R - C - OH + Perse2O + 2 H2O
aldehüüd punakaspruun sade
3- Benedictuse reaktiivne: See reaktiivne moodustub ka vask II sulfaadi lahusega (Cu (OH)2) aluselises keskkonnas, kuid see segatakse naatriumtsitraadiga.
Nagu Fehlingi reaktiivi puhul, on ka aldehüüdi ja Benedictusreagendi vahelise reaktsiooni korral ka vase ioone (Cu2+) keskkonnas, mis on redutseeritud ja moodustavad punase vaskoksiidi.
Seda reagenti kasutatakse testides laialdaselt glükoosi olemasolu ja sisalduse tuvastamiseks uriinis. Glükoosi struktuuris on aldehüüdirühm, nii et see reageerib nende testide jaoks ribades oleva Benedikti reagendiga. Sealt saate lihtsalt võrrelda lindi värvi toote pakendil oleva skaala värviga.

Benedikti reagenti kasutatakse glükoosisisalduse määramiseks uriinis.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Aldehüüdide ja ketoonide diferentseerimine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm. Juurdepääs 27. juunil 2021.
Keemia

Aldehüüdid, karbonüülühendid, karbonüülrühm, Peamised aldehüüdid, Etanaal, pestitsiidide ja ravimitööstuse tooraine, Metanal, formaldehüüdi-, plasti- ja vaigutööstus.
Keemia

Ketoonid, orgaanilised ained, funktsionaalne karbonüülrühm, emaililahusti saamine, propanoon, ketoonkehad vereringes, õlide ja rasvade ekstraheerimine taimseemnetest, lahustitest Orgaaniline.


