Pöörduvate ja pöördumatute protsesside mõisteid saab entroopia mõiste abil matemaatiliselt kirjeldada. Kuid enne entroopia määratluseni jõudmist pöördume pöörduvate ja pöördumatute protsesside mõistete juurde. me helistame pöörduv protsess selline, kus süsteem saab spontaanselt naasta algsesse olukorda (või olekusse). Pöördumatu protsess on selline, mille süsteem ei saa spontaanselt algsesse olekusse naasta.
Kuna protsessitüüpide mõisted on juba mainitud, läheme entroopia määratlusele. THE entroopia süsteem (S) on selle organiseerimatuse aste. Mida suurem on organisatsioon, seda väiksem on entroopia. Entroopia on termodünaamilise seisundi, samuti siseenergia, maht ja moolide arv.
Vaadates ülaltoodud joonisel olevaid konteinereid, näeme, et konteineril 1 on entroopia väiksem kui teine. Kui võtame konteineri ja raputame seda, kontrollime, kas “pallid” on segunenud või pigem korrastamata. Kui kontrollime konteinerit 2, märkame pärast selle raputamist, et pallide jaoks pole see võimalik, pöörduge spontaanselt tagasi oma algsesse organisatsiooni, kui jätkame konteiner.
Pöörduvates isotermilistes (mille temperatuur jääb alati samaks) pöördprotsessides määratleme entroopia kui soojuse (antud või saadud) suhe temperatuurini. Seega esindame entroopiat isotermilistes protsessides järgmiselt:
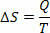
Rahvusvahelises ühikute süsteemis mõõdame entroopiat džaulides / kelviinides. Lähtudes entroopia kohta kirjeldatavast kontseptsioonist, võime sõnastada teise seaduse järgmiselt:

Isoleeritud süsteemi entroopia muutus on alati positiivne või null. Võrdsus ΔS = 0 tekib siis, kui protsessid on pöörduvad: pöörduvad protsessid ei suurenda entroopiat. Eraldatud süsteemide puhul, mis ei saa keskkonda ega anna soojust, saab entroopiat ainult suurendada või hoida konstantsena.
Autor Domitiano Marques
Lõpetanud füüsika
Brasiilia koolimeeskond
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm


