Energíainterno es la suma de energías cinéticas y potencial relacionado con el movimiento de los átomos y moléculas constituyentes de un cuerpo. La energía interna también es directamente proporcional a la temperatura del cuerpo. Es una cantidad escalar medida en julios (SI) y determinada en función de variables como presión (PAG), volumen (V) y temperatura termodinámica (T) de un sistema, en Kelvin (K).
Cuanto mayor es la temperatura de un cuerpo, mayor es su energía interna, por lo tanto, mayor es su capacidad para realizar algún trabajo. Además, la energía interna de los gases monoatómicos, por ejemplo, viene dada exclusivamente por la suma de energía cinética de cada átomo del gas. Cuando se trata de gases moleculares, como los gases diatómicos, se deben tener en cuenta las interacciones moleculares y, para esto, la energía interna está determinada por la suma de la energía cinética de las moléculas con la energía potencial existente entre ellos.
No pares ahora... Hay más después de la publicidad;)
Energía interna de gases monoatómicos ideales
Como no hay interacción entre los átomos de un gas monoatómico ideal, su energía interna depende exclusivamente de dos variables: el número de moles (n) y la temperatura del gas (T). Mirar:
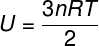
U - energía interna
No - número de lunares
R - constante universal de gases perfectos
T - temperatura
En la ecuación anterior, R tiene un módulo de 0.082 atm. L / mol. K o 8,31 J / mol. K (SI). Además, podemos escribir la ecuación anterior en términos de otras cantidades, como presión y volumen. Para eso, necesitamos recordar el Ecuación de Clapeyron, utilizado para gases ideales.
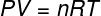
Sustituyendo la ecuación anterior por la anterior, tendremos la siguiente expresión para el cálculo de la energía interna:
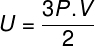
veaademás:¿Qué es un gas perfecto?
Teniendo en cuenta las ecuaciones anteriores, es posible determinar una relación entre la energía cinética de los átomos de un gas monoatómico ideal y su temperatura. Para ello, diremos que la energía cinética de este tipo de gas es puramentecinética. Mirar:
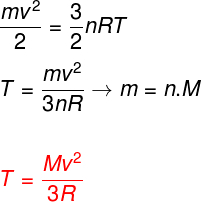
metro - pasta
No - número de mole
METRO - masa molar
En muchas situaciones, es interesante saber cómo calcular la variación de la energía interna (ΔU) de un gas, ya que esta cantidad indica si el gas ha recibido o cedió energía. Si la variación de la energía interna del gas ha sido positiva (ΔU> 0), el gas habrá recibido energía; de lo contrario (ΔU <0), el gas habrá cedido parte de su energía.
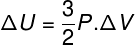
Variación de energía interna en términos de variación de volumen de gas.
Energía interna para gases diatómicos
Para los gases diatómicos ideales, la energía interna viene dada por una ecuación ligeramente diferente.
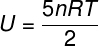
Energía interna en transformaciones y ciclos termodinámicos
De acuerdo con 1ra ley de la termodinámica, la energía interna de un gas ideal puede variar en ciertos transformaciones termodinámicas, dependiendo de la cantidad de calor intercambiado entre el entorno y el sistema, así como el trabajo realizado por o sobre el sistema.
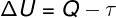
Q - calor
τ - trabaja
A continuación, veamos la forma que adopta esta ley para algunas transformaciones termodinámicas particulares.
veaademás:Historia de las máquinas térmicas
→ Energía interna: transformación isotérmica
A transformación isotérmica, no hay cambio de temperatura y por lo tanto la energía interna permanece constante.
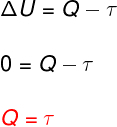
En este caso, toda la cantidad de calor que se intercambia con el sistema se convierte en trabajo y viceversa.
→ Energía interna: transformación isovolumétrica
A transformación isovolumétrica, no es posible realizar trabajos, ya que el sistema está confinado en un contenedor rígido e inexpugnable. En este caso, la cantidad total de calor que se intercambia con el sistema varía directamente su energía interna.
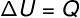
→ Energía interna: transformación isobárica
En este tipo de transformación, el sistema se somete a una presión constantepor tanto, el trabajo realizado por él o sobre él puede calcularse analíticamente.
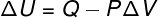
→ Energía interna: transformación adiabática
En el transformaciones adiabáticas, no existen intercambios de calor entre el sistema y su entorno, por lo tanto, la variación de la energía interna depende exclusivamente del trabajo realizado por o sobre el sistema.
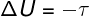
Energía interna en procesos cíclicos
En todo proceso cíclico, el estado termodinámico de un sistema, representado por sus variables de presión, volumen y temperatura (P, V, T), es transformado, pero termina volviendo al estado original (P, V, T), por lo tanto, la variación de la energía interna en este tipo de procesos es siempre nula (ΔU = 0).
veaademás:Transformaciones cíclicas
Mire el gráfico a continuación, que muestra tres transformaciones termodinámicas distintas entre los estados A y B.
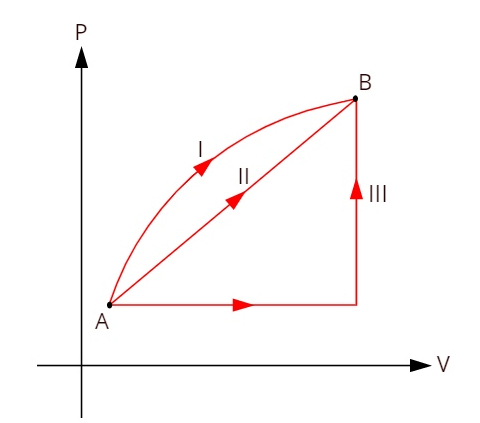
Como las tres transformaciones (I, II y III) salen del estado A y pasan al estado B, la variación de energía interna debe ser igual para todas ellas, por lo tanto:
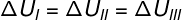
Ejercicios de energía interna
1) Dos moles de un gas diatómico ideal, con una masa molar igual a 24 g / mol, se encuentran a una temperatura de 500 K dentro de un recipiente rígido cerrado con un volumen igual a 10-3 m³. Determinar:
a) El módulo de la energía interna de este gas en julios.
b) La presión que ejerce el gas sobre las paredes del recipiente.
Resolución:
La) Dado que es un gas ideal y diatómico, utilizaremos la siguiente fórmula para calcular su energía interna:
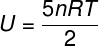
Tomando los datos que fueron informados en la declaración de ejercicio, tendremos el siguiente cálculo a resolver:
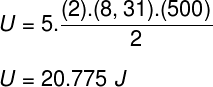
B) Podemos determinar la presión que ejerce el gas una vez que conocemos el volumen de su recipiente: 10-3 m³. Para hacer esto, usaremos la siguiente fórmula:
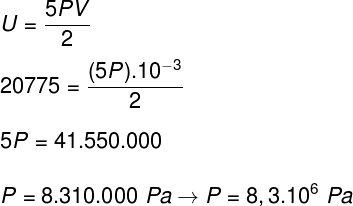
Por mí. Rafael Helerbrock