LOS solubilidadPuede ser definido como la cantidad máxima posible de un soluto que se puede disolver en una cierta cantidad de solvente a una temperatura dada.
Esta cantidad máxima que se puede disolver también se conoce como coeficiente de solubilidad o grado de solubilidad. Pero la solubilidad de cualquier sustancia depende, entre otras cosas, del tipo de disolvente en el que se dispersa el soluto.
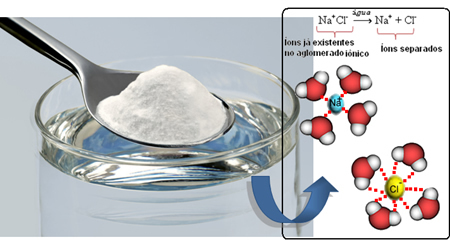
Por ejemplo, el NaCl (cloruro de sodio - sal de mesa) es muy soluble en agua, y en 1 L de agua a 20ºC, podemos solubilizar hasta 360 gramos de esta sal. Pero cuando el disolvente se convierte en gasolina, en las mismas condiciones de volumen, temperatura y presión, la sal no se disuelve.
¿Por qué la solubilidad de una sustancia varía tanto de un solvente a otro?
Uno de los factores es la polaridad de los compuestos implicados. En el ejemplo citado, tenemos que la sal es polar, el agua es polar y la gasolina no es polar. La sal está formada por átomos de sodio (Na) y cloro (Cl) que se unen a través de enlaces iónicos, en los que el sodio definitivamente dona un electrón al cloro, formando iones de Na
+ y Cl-. Como estos iones tienen cargas opuestas, se atraen y se mantienen juntos (Na+Cl-).
Esto nos muestra que la sal es realmente polar, cada enlace iónico es polar, ya que hay una diferencia en la carga eléctrica en el compuesto.
En el caso del agua, el enlace existente es covalente, en el que dos átomos de hidrógeno comparten electrones con un átomo de oxígeno. La molécula de agua tiene dos dipolos, el oxígeno tiene una carga parcialmente negativa y el hidrógeno tiene una carga parcialmente positiva (δ- O ─ H δ+). Pero estos dipolos no se anulan entre sí, porque la molécula de agua se encuentra en un ángulo de 104,5º, lo que demuestra que la distribución y la carga a lo largo de la molécula no es uniforme. Hay una mayor densidad de carga negativa en el átomo de oxígeno de la molécula. Esto nos muestra que la molécula de agua es realmente polar.
No pares ahora... Hay más después de la publicidad;)
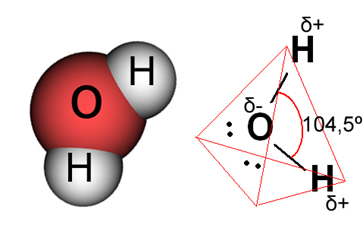
Entonces, cuando mezclamos la sal con el agua, la parte positiva de la sal, que son los cationes de Na.+, es atraído por la parte negativa del agua, que es el oxígeno, y la parte negativa de la sal (aniones Cl-) es atraído por la parte positiva del agua (H+). En consecuencia, la unión Na+Cl- se rompe solubilizando la sal en el agua.
La gasolina, en cambio, está formada por una mezcla de diferentes hidrocarburos, los cuales son apolares, es decir, la distribución de la carga eléctrica de la gasolina es uniforme. Por lo tanto, no hay interacción de los iones de sal con la gasolina y no se disuelve.
Estos y otros casos similares nos llevan a la siguiente conclusión:

Sin embargo, esto no puede considerarse una regla general, ya que hay muchos casos de solutos no polares que se disuelven bien en solventes polares y viceversa. Entonces, para entender por qué ocurre esto, tenemos que considerar otro factor: el tipo de Fuerza intermolecular del solvente y el soluto.
Ley sobre esto en el texto: "Relación entre fuerza intermolecular y solubilidad de sustancias”.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Relación entre polaridad y solubilidad de sustancias"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. Consultado el 27 de julio de 2021.