Isomery es el fenómeno caracterizado por la aparición de dos o más sustancias diferentes, que tienen la misma fórmula molecular, pero diferentes fórmulas estructurales.
en llamada isomería plana la diferencia entre dos isómeros (compuestos que sufren isomería) se verifica mediante el estudio de sus fórmulas estructurales planas. Tenemos cinco casos en los que se produce esta isomería.
• Isomería de posición: los isómeros tienen el mismo tipo de cadena y pertenecen a la misma función, sin embargo, se diferencian en la posición de un grupo funcional, una insaturación o una rama.

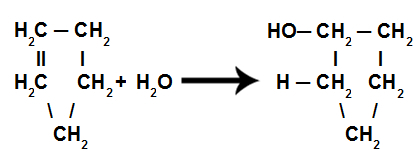
La diferencia entre los isómeros está en la insaturación (doble enlace), indicada por los números 1 y 2.
• Isomería en cadena: los isómeros pertenecen a la misma función, pero tienen diferentes tipos de cadena.
• Isomería de función: los isómeros pertenecen a diferentes funciones. Esta isomería ocurre principalmente con las funciones: fenol, alcohol, éter, aldehídos y cetonas, ácido carboxílico y éster.

El alcohol y el fenol anteriores tienen la misma fórmula molecular: C
7H8O, pero pertenecen a las funciones:Fenoles: compuestos que tienen el grupo hidroxilo (-OH) directamente ligado al anillo aromático.
Alcoholes: tienen (-OH) enlazado a carbono saturado.
• isómero dinámico: también conocido como tautomeria, es un caso particular de isomería, en el que los isómeros pertenecientes a diferentes funciones químicas establecen un equilibrio químico dinámico.

Enol de aldehído
Si reemplazamos el reactivo de aldehído por una cetona, tendremos el mismo producto (enol):

Enol de cetona
Luego decimos que el aldehído y la cetona (diferentes funciones químicas) son tautómeros (isómeros).
• Isomería de compensación: en este caso, los isómeros pertenecen a la misma función y tienen el mismo tipo de cadena. La diferencia está en la posición del heteroátomo. Recordando que el heteroátomo es un átomo diferente del carbono presente en las cadenas de carbono. Ejemplo:
No pares ahora... Hay más después de la publicidad;)
Ambas cadenas pertenecen a la función (amina) y llevan la misma cantidad de carbonos e hidrógenos. El diferencial está en la posición N (heteroátomo). En la metil-propilamina, el nitrógeno se encuentra al final de la cadena y en la dietilamina está en el centro.
Por Líria Alves
Licenciada en Química
¡Vea mas! isómero espacial
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
SOUZA, Líria Alves de. "Isomería plana"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/isomeria-plana.htm. Consultado el 27 de junio de 2021.