Kc es el acrónimo que representa el constante de equilibrio en términos de concentración de una reacción química particular. Se utiliza siempre que nos referimos al establecimiento o no del equilibrio en una reacción química. Para ello, siempre es necesario realizar un cálculo de Kc, que utiliza las concentraciones en cantidad de materia de los participantes de la reacción.
LA Interpretación kc es muy simple, porque cuando:
Kc = 1, el sistema de reacción está en equilibrio;
Kc> 1, el sistema no está en equilibrio y predomina la reacción directa;
Kc <1, el sistema no está en equilibrio y predomina la reacción inversa.
Es importante destacar que la interpretación de Kc depende del conocimiento sobre el equilibrio químico.
Tenemos un equilibrio químico cuando una reacción química es reversible, es decir, presenta una reacción directa (los reactivos forman los productos) y una reacción inversa (los productos forman los reactivos), y la velocidad de reacción hacia adelante es exactamente la misma que la velocidad de reacción hacia atrás. Vea un ejemplo:

En el ejemplo anterior, tenemos un equilibrio químico (indicado por las dos flechas), ya que hay un reacción directa (A + B formando C + D) y el reacción inversa (C + D formando A + B). Los coeficientes a, b, c, d equilibran la ecuación.
Cada uno de los participantes en una reacción siempre tiene un concentración en cantidad de materia (mol / L). Con los valores de concentración, podemos calcular el Kc de la reacción. Sin embargo, para realizar este cálculo, es necesario ensamblar la expresión Kc.
El ensamblaje de la expresión Kc siempre usa el mismo patrón. Con este patrón, multiplicamos las concentraciones de productos elevados a sus respectivos exponentes y divididos por la multiplicación de reactivos elevados a sus respectivos exponentes.
La expresión Kc para el balance genérico a continuación sería:

No pares ahora... Hay más después de la publicidad;)
Kc = [C]C.[D]D
[LA]La.[B]B
En la expresión de Kc, nunca usamos participantes sólidos o agua líquida, ya que son elementos constantes en la reacción.
Vea algunos ejemplos:
Ejemplo 1: Equilibrio de formación de amoniaco
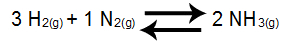
En el balance anterior, el producto es NH3, que tiene un coeficiente de 2, y los reactivos son H2 y entonces2, que presentan, respectivamente, los coeficientes 3 y 1. Todos los participantes del equilibrio son gaseosos, por lo que pueden formar parte de Kc. A partir de estos datos, la expresión Kc será:
Kc = [NUEVA HAMPSHIRE3]2
[H2]3.[NORTE2]1
Ejemplo 2: Balance de la descomposición del carbonato de calcio
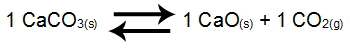
En el balance anterior, los productos CaO y el CO2y el reactivo CaCO3tienen coeficiente 1. ¿Cómo CaCO3 y CaO son sólidos, no pueden formar parte de Kc. A partir de estos datos, la expresión de equilibrio de Kc será:
Kc = [CO2]1
NOTA: La expresión no tendrá denominador porque el reactivo es sólido. Entonces, dejamos la expresión sin denominador o ponemos el número 1 en el denominador (número que indica la constancia de un participante).
Ejemplo 3: Equilibrio de la formación de cloruro de amonio
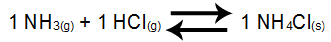
En el equilibrio anterior, los reactivos de NH3 y el producto HCl y NH4Cl tiene coeficiente 1. Como partícipe del saldo NH4Cl es sólido, no puede formar parte de Kc. A partir de estos datos, la expresión de equilibrio de Kc será:
Kc = 1
[NUEVA HAMPSHIRE3]1. [HCl]1
NOTA: Como no tenemos ningún saldo participante en el numerador, es necesario colocar el número 1 (número que indica la constancia de un participante).
Por mí. Diogo Lopes Dias
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
DÍAS, Diogo Lopes. "¿Qué es Kc?"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kc.htm. Consultado el 28 de junio de 2021.
¿Qué es la Química?

Entender qué es Kp, la constante de equilibrio en términos de presión, y saber cómo obtenerla usando presiones. parciales de todos los gases presentes en un equilibrio químico, que puede estar en atmósferas (atm) o milímetros de mercurio (mmHg). ¡Haga clic aquí y descubra más sobre este tema!
Química

Pon a prueba tus conocimientos y aprende más con esta lista de ejercicios resueltos sobre balances químicos. A través de este material, podrá comprender mejor cómo trabajar las constantes de equilibrio (Kp, Kc y Ki), cambio de equilibrio, pH y pOH, así como el equilibrio en las llamadas soluciones tampón.
